AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA
DIRETORIA COLEGIADA
CONSULTA PÚBLICA Nº 1.071, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, aliado ao art. 7º, III e IV da Lei nº 9.782, de 26 de janeiro de 1999, e ao art. 187, III, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve submeter à consulta pública, para comentários e sugestões do público em geral, proposta de ato normativo, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
Art. 1º Fica estabelecido o prazo de sessenta dias para envio de comentários e sugestões ao texto da proposta de Consulta Pública sobre a Resolução de Diretoria Colegiada que dispõe sobre o regulamento técnico de atribuição de aditivos alimentares e coadjuvantes de tecnologia para a categoria de alimentos 1. produtos lácteos, subcategorias leite em pó e creme de leite em pó, leites fermentados e queijos, conforme Anexo.
Parágrafo único. O prazo de que trata este artigo terá início 7 (sete) dias após a data de publicação desta Consulta Pública no Diário Oficial da União.
Art. 2º A proposta de ato normativo estará disponível na íntegra no portal da Anvisa na internet e as sugestões deverão ser enviadas eletronicamente por meio do preenchimento de formulário específico, disponível no endereço: https://pesquisa.anvisa.gov.br/index.php/373692?lang=pt-BR
§1º As contribuições recebidas são consideradas públicas e estarão disponíveis a qualquer interessado por meio de ferramentas contidas no formulário eletrônico, no menu "resultado", inclusive durante o processo de consulta.
§2º Ao término do preenchimento do formulário eletrônico será disponibilizado ao interessado número de protocolo do registro de sua participação, sendo dispensado o envio postal ou protocolo presencial de documentos em meio físico junto à Agência.
§3º Em caso de limitação de acesso do cidadão a recursos informatizados será permitido o envio e recebimento de sugestões por escrito, em meio físico, durante o prazo de consulta, para o seguinte endereço: Agência Nacional de Vigilância Sanitária/GEARE, SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
§4º Excepcionalmente, contribuições internacionais poderão ser encaminhadas em meio físico, para o seguinte endereço: Agência Nacional de Vigilância Sanitária/Assessoria de Assuntos Internacionais - AINTE, SIA trecho 5, Área Especial 57, Brasília-DF, CEP 71.205-050.
Art. 3º Findo o prazo estipulado no art. 1º, a Agência Nacional de Vigilância Sanitária promoverá a análise das contribuições e, ao final, publicará o resultado da consulta pública no portal da Agência.
Parágrafo único. A Agência poderá, conforme necessidade e razões de conveniência e oportunidade, articular-se com órgãos e entidades envolvidos com o assunto, bem como aqueles que tenham manifestado interesse na matéria, para subsidiar posteriores discussões técnicas e a deliberação final da Diretoria Colegiada.
ANTONIO BARRA TORRES
Diretor-Presidente
DESPACHO N° 5, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) prevista no art. 18 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.904982/2019-70
Assunto: Proposta de abertura de processo regulatório para estabelecer os aditivos alimentares e coadjuvantes de tecnologia autorizados para uso em leite em pó, creme de leite em pó, leites fermentados e queijos.
Área responsável: GEPAR/GGALI/DIRE2
Agenda Regulatória 2021-2023: Projeto nº 3.6
Excepcionalidade: Dispensa de Análise de Impacto Regulatório (AIR) para manter a convergência a padrões internacionais.
Relatoria: Rômison Rodrigues Mota
DESPACHO Nº 6, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) e de Consulta Pública (CP) previstas, respectivamente, no art. 18 e no art. 39 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.928328/2021-76
Assunto: Proposta de abertura de processo regulatório para alteração da Instrução Normativa nº 51, de 19 de dezembro de 2019, que estabelece a lista de limites máximos de resíduos (LMR), ingestão diária aceitável (IDA) e dose de referência aguda (DRfA) para insumos farmacêuticos ativos (IFA) de medicamentos veterinários em alimentos de origem animal.
Área responsável: GEPAR/GGALI/DIRE2
Agenda Regulatória 2021-2023: Não é projeto regulatório da Agenda (Assunto de Atualização Periódica)
Excepcionalidade: Não é projeto regulatório da Agenda, dispensa de Análise de Impacto Regulatório (AIR) por motivo de baixo impacto e dispensa de Consulta Pública (CP) por se mostrar improdutiva, considerando a finalidade e os princípios da eficiência, razoabilidade e proporcionalidade administrativas.
Relatoria: Meiruze Sousa Freitas
DESPACHO N° 7, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) e de Consulta Pública (CP) previstas, respectivamente, no art. 18 e no art. 39 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.924810/2021-37
Assunto: Proposta de abertura de processo regulatório para aprovação da Errata nº 1 do Formulário de Fitoterápicos da Farmacopeia Brasileira, 2ª edição.
Área responsável: Coordenação da Farmacopeia (COFAR/GELAS)
Agenda Regulatória 2021-2023: Não é projeto regulatório da Agenda (Atualização Periódica)
Excepcionalidade: Não é projeto regulatório da Agenda, dispensa de Análise de Impacto Regulatório (AIR) por motivo de baixo impacto e dispensa de Consulta Pública (CP) por se mostrar improdutiva, considerando a finalidade e os princípios da eficiência, razoabilidade e proporcionalidade administrativas.
Relatoria: Alex Machado Campos
DESPACHO N° 8, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, §§ 1º e 3º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) e de Consulta Pública (CP) previstas, respectivamente, no art. 18 e no art. 39 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.921201/2021-26
Assunto: Abertura de processo regulatório para atualizar a Instrução Normativa - IN nº 84, de 12 de março de 2021, que dispõe sobre a lista de dispositivos médicos selecionados para monitoramento econômico pela Anvisa
Área responsável: Gerência de Estudos Econômicos e Inteligência Regulatória (GECOR/GGREG)
Agenda Regulatória 2021-2023: Não é projeto regulatório da Agenda (Atualização Periódica)
Excepcionalidades: Dispensa de Análise de Impacto Regulatório (AIR) por motivo de baixo impacto e dispensa de Consulta Pública (CP) por se mostrar improdutiva, considerando a sua finalidade e os princípios da eficiência, razoabilidade e proporcionalidade administrativas
Relatoria: Alex Machado Campos
DESPACHO N° 9, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, §§ 1º e 3º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) e de Consulta Pública (CP) previstas, respectivamente, no art. 18 e no art. 39 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.921201/2021-26
Assunto: Abertura de processo regulatório para atualizar a Instrução Normativa - IN nº 105, de 27 de outubro de 2021, que dispõe sobre os atributos técnicos dos dispositivos médicos selecionados para monitoramento econômico pela Anvisa
Área responsável: Gerência de Estudos Econômicos e Inteligência Regulatória (GECOR/GGREG)
Agenda Regulatória 2021-2023: Não é projeto regulatório da Agenda (Atualização Periódica)
Excepcionalidades: Dispensa de Análise de Impacto Regulatório (AIR) por motivo de baixo impacto e dispensa de Consulta Pública (CP) por se mostrar improdutiva, considerando a sua finalidade e os princípios da eficiência, razoabilidade e proporcionalidade administrativas
Relatoria: Alex Machado Campos
DESPACHO N° 10, DE 2 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar a abertura do Processo Administrativo de Regulação, em Anexo, com dispensa de Análise de Impacto Regulatório (AIR) e de Consulta Pública (CP) previstas, respectivamente, no art. 18 e no art. 39 da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo nº: 25351.932544/2021-16
Assunto: Proposta de abertura de processo regulatório para alterar a RDC nº 69, de 23 de março de 2016, que dispõe sobre o "Regulamento Técnico Mercosul sobre lista de filtros ultravioletas permitidos para produtos de higiene pessoal, cosméticos e perfumes".
Área responsável: CCOSM/GHCOS
Agenda Regulatória 2021-2023: Projeto 4.1 - Atualização de listas de substâncias permitidas (conservantes, corantes, filtros e alisantes), com uso restrito ou proibidas em produtos de higiene pessoal, cosméticos e perfumes.
Excepcionalidade: Dispensa de Análise de Impacto Regulatório (AIR) para manter a convergência a padrões internacionais e Dispensa de Consulta Pública (CP) por se mostrar improdutiva, considerando a finalidade e os princípios da eficiência, razoabilidade e proporcionalidade administrativas.
Relatoria: Antonio Barra Torres
DESPACHO N° 12, DE 7 DE FEVEREIRO DE 2022
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, da Lei nº 9.782, de 26 de janeiro de 1999, aliado ao art. 187, X, §§ 1º e 3º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve aprovar as dispensas de Monitoramento e da Avaliação de Resultado Regulatório (M&ARR) dos processos concluídos, em anexo, de acordo com o art. 57 e o art. 83-A da Portaria nº 162, de 12 de março de 2021, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
ANTONIO BARRA TORRES
Diretor-Presidente
ANEXO
Processo: 25351.913456/2021-15
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 514, de 28 de maio de 2021, que altera a Resolução de Diretoria Colegiada - RDC nº 332, de 23 de dezembro de 2019, que define os requisitos para uso de gorduras trans industriais em alimentos, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR representa o emprego de recursos desproporcionais aos eventuais impactos esperado.
Área: GGALI/DIRE2
Diretora Relatora: Meiruze Sousa Freitas
Processo: 25351.927391/2021-95
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 568, de 29 de setembro de 2021, que dispõe, de forma extraordinária e temporária, sobre a permissão de uso dos medicamentos e produtos biológicos utilizados no tratamento e prevenção da Covid-19, provenientes do estoque remanescente dos ensaios clínicos conduzidos ou em andamento no Brasil, em virtude emergência de saúde pública de importância nacional decorrente do surto do novo Coronavírus (SARS-CoV-2), por tratar-se de ato normativo de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR representa o emprego de recursos desproporcionais aos eventuais impactos esperados.
Área: GPBIO/GGMED/DIRE2
Diretora Relatora: Meiruze Sousa Freitas
Processo: 25351.912598/2021-65
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 517, de 10 de junho de 2021, que dispõe sobre os critérios e requisitos excepcionais e temporários, em virtude da emergência de saúde pública internacional decorrente do novo Coronavírus, para isenção das bulas nas embalagens e informações de rotulagem para as apresentações de medicamentos de uso restrito a hospitais, clínicas, ambulatórios e serviços de atenção domiciliar , exceto farmácias e drogarias, por tratar-se de ato normativo de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR representa o emprego de recursos desproporcionais aos eventuais impactos esperados.
Área: GQMED/GGMED/DIRE2
Diretora Relatora: Meiruze Sousa Freitas
Processo: 25351.922466/2021-41
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 534, de 23 de agosto de 2021, que dispõe de forma extraordinária e temporária sobre submissão contínua de dossiês de desenvolvimento clínico de vacinas Covid-19 pelas universidades públicas brasileiras ou instituições com financiamento público, por tratar-se de ato normativo de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR representa o emprego de recursos desproporcionais aos eventuais impactos esperados.
Área: GGMED/DIRE2
Diretora Relatora: Meiruze Sousa Freitas
Processo: 25351.926153/2021-62
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 573, de 29 de outubro de 2021, que altera de forma emergencial e temporária a Resolução da Diretoria Colegiada - RDC nº 9, de 20 de fevereiro 2015, que aprova o regulamento para a realização de ensaios clínicos com medicamentos no Brasil, por tratar-se de ato normativo de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR representa o emprego de recursos desproporcionais aos eventuais impactos esperados.
Área: Copec/GGMED/DIRE2
Diretora Relatora: Meiruze Sousa Freitas
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 489, de 7, de abril de 2021, que altera a RDC nº 483, de 19 de março de 2021, que dispõe, de forma extraordinária e temporária, sobre os requisitos para a importação de dispositivos médicos novos e medicamentos identificados como prioritários para uso em serviços de saúde, em virtude da emergência de saúde pública internacional relacionada ao SARS-CoV-2, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 496, de 11, de maio de 2021, que prorroga por 60 (sessenta) dias a vigência da RDC nº 483, de 19 de março de 2021, que dispõe, de forma extraordinária e temporária, sobre os requisitos para a importação de dispositivos médicos novos e medicamentos identificados como prioritários para uso em serviços de saúde, em virtude da emergência de saúde pública internacional relacionada ao SARS-CoV-2, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 516, de 2, de junho de 2021, que altera a RDC nº 483, de 19 de março de 2021, que dispõe, de forma extraordinária e temporária, sobre os requisitos para a importação de dispositivos médicos novos e medicamentos identificados como prioritários para uso em serviços de saúde, em virtude da emergência de saúde pública internacional relacionada ao SARS-CoV-2, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 524, de 14, de julho de 2021, que prorroga por 60 (sessenta) dias a vigência da RDC nº 483, de 19 de março de 2021, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 531, de 4, de agosto de 2021, que altera a RDC nº 483, de 19 de março de 2021, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.922329/2021-15
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 533, de 23, de agosto de 2021, que estabelece procedimentos excepcionais e temporários para importação das vacinas Covid-19 regularizadas na Anvisa e seus insumos para o enfrentamento da emergência de saúde pública de importância nacional decorrente do surto do novo Coronavírus (SARS-CoV-2), por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e desproporcional.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.907896/2021-33
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 561, de 1º, de setembro de 2021, que prorroga por 60 (sessenta) dias a vigência da RDC nº 483, de 19 de março de 2021, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual a realização de M&ARR se considera improdutiva e cujos recursos empregados para a sua realização são desproporcionais frente aos impactos esperados com o ato.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.925653/2021-87
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 563, de 15, de setembro de 2021, que dispõe, de forma extraordinária e temporária, sobre os requisitos para a importação e uso de imunoglobulina humana, em virtude da emergência de saúde pública internacional relacionada ao SARSCoV-2, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual o esforço para a realização de M&ARR pode ser desproporcional e improdutivo face ao acompanhamento rotineiro dessas importações que são tratadas como prioritárias.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.925653/2021-87
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 583, de 2 de dezembro de 2021, que altera a Resolução de Diretoria Colegiada - RDC nº 563, de 15 de setembro de 2021, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual o esforço para a realização de M&ARR pode ser desproporcional e improdutivo face ao acompanhamento rotineiro dessas importações que são tratadas como prioritárias.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.926882/2021-19
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 567, de 29, de setembro de 2021, que dispõe sobre os critérios e procedimentos temporários e excepcionais para importação de radiofármacos industrializados constantes na Instrução Normativa nº 81, de 16 de dezembro de 2020, da Anvisa e suas atualizações, em virtude do risco de desabastecimento em território nacional, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual o esforço para a realização de M&ARR pode ser desproporcional e improdutivo face ao acompanhamento rotineiro dessas importações que são tratadas como prioritárias.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.926882/2021-19
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 582, de 2 de dezembro de 2021, que prorroga a vigência da Resolução de Diretoria Colegiada nº 567, de 29 de setembro de 2021, por tratar-se de ato normativo com vigência temporária e de caráter excepcional para tratar situação específica e pontual para a qual o esforço para a realização de M&ARR pode ser desproporcional e improdutivo face ao acompanhamento rotineiro dessas importações que são tratadas como prioritárias.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.928318/2021-31
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 574, de 29, outubro de 2021, que dispõe sobre os requisitos sanitários para o embarque, desembarque e transporte de viajantes em embarcações de cruzeiros marítimos localizadas em águas jurisdicionais brasileiras, incluindo aquelas com viajantes provenientes de outro País, em virtude da Emergência de Saúde Pública de Importância Internacional - ESPII decorrente da pandemia de SARS-CoV-2, por tratar-se de ato normativo com vigência temporária para o qual a realização de M&ARR se torna improdutiva.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.928318/2021-31
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 578, de 25, de novembro de 2021, que altera a RDC nº 574, de 29 de outubro de 2021, por tratar-se de ato normativo com vigência temporária para o qual a realização de M&ARR se torna improdutiva.
Área: GGPAF/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.048778/2012-10
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Instrução Normativa - IN nº 108, de 25, de novembro de 2021 que altera a IN nº 100, de 23 de agosto de 2021, por tratar-se de ato normativo de vigência temporária e de caráter excepcional por regulamentar situação específica e pontual.
Área: GGMON/DIRE5
Diretor Relator: Alex Machado Campos
Processo: 25351.901311/2021-71
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Instrução Normativa - IN nº 99, de 5 de agosto de 2021, que altera o artigo 34 da IN nº 38, de 21 de agosto de 2019, que dispõe sobre as Boas Práticas de Fabricação complementares a Gases Substâncias Ativas e Gases Medicinais, por tratar-se de ato normativo para tratar de situação específica e pontual para a qual a realização de M&ARR representaria um emprego de recursos incompatíveis ao objetivo da norma - como também mostra-se improdutiva - considerando a vigência temporária da norma.
Área: GIMED/GGFIS/DIRE4
Diretor Relator: Rômison Rodrigues Mota
Processo: 25351.908991/2020-73
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 495, de 16 de abril de 2021, que define os critérios e os procedimentos extraordinários e temporários para a exposição à venda de preparações antissépticas ou sanitizantes oficinais, em virtude da emergência de saúde pública de importância nacional decorrente do surto do novo coronavírus (SARS-CoV-2), por tratar-se de ato normativo de vigência temporária cuja realização de M&ARR se mostra improdutiva.
Área: GGFIS/DIRE4
Diretor Relator: Rômison Rodrigues Mota
Processo: 25351.919191/2021-69
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Resolução de Diretoria Colegiada - RDC nº 580, de 26 de novembro de 2021, que altera o artigo 372 da RDC nº 301, de 21 de agosto de 2019, que dispõe sobre as Diretrizes Gerais de Boas Práticas de Fabricação de Medicamentos, por tratar-se de ato normativo para tratar de situação específica e pontual cuja realização de M&ARR se mostra desproporcional.
Área: GIMED/GGFIS/DIRE4
Diretor Relator: Rômison Rodrigues Mota
Processo: 25351.919191/2021-69
Assunto: Dispensa de realização de Monitoramento e Avaliação de Resultado Regulatório (M&ARR) da Instrução Normativa - IN nº 109, de 26 de novembro de 2021, que altera o artigo 175 da IN nº 35, de 21 de agosto de 2019, que dispõe sobre as Boas Práticas de Fabricação complementares a Medicamentos Estéreis, por tratar-se de ato normativo para tratar de situação específica e pontual cuja realização de M&ARR se mostra desproporcional.
Área: GIMED/GGFIS/DIRE4
Diretor Relator: Rômison Rodrigues Mota
INSTRUÇÃO NORMATIVA - IN N° 117, DE 2 DE FEVEREIRO DE 2022
Altera a Instrução Normativa nº 51, de 19 de dezembro de 2019.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o art. 15, III e IV aliado ao art. 7º, III, da Lei n.º 9.782, de 26 de janeiro de 1999, e ao art. 187, II e VII, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC n° 585, de 10 de dezembro de 2021, em reunião realizada em 1º de fevereiro de 2022, resolve:
Art. 1º Esta Instrução Normativa altera a Instrução Normativa nº 51, de 19 de dezembro de 2019, para atualizar a lista de limites máximos de resíduos (LMR), ingestão diária aceitável (IDA) e dose de referência aguda (DRfA) para insumos farmacêuticos ativos (IFA) de medicamentos veterinários em alimentos de origem animal.
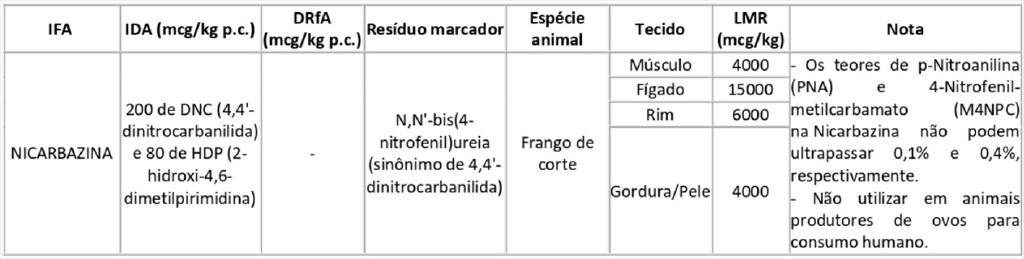
Art. 2º A autorização do IFA "Nicarbazina" na "Lista de IDA, DRfA e LMR para IFA com uso autorizado" do Anexo I da Instrução Normativa nº 51, de 2019, passa a vigorar na forma do Anexo I desta Instrução Normativa.
Art. 3º A "Lista de IFA de medicamentos veterinários em alimentos de origem animal com LMR não necessário" do Anexo II da Instrução Normativa nº 51, de 2019, passa a vigorar com o acréscimo do IFA relacionado no Anexo II desta Instrução Normativa.
Art. 4º Esta Instrução Normativa entra em vigor no dia 2 de março de 2022.
ANTONIO BARRA TORRES
Diretor Presidente
ANEXO I
ALTERAÇÃO DO IFA NICARBAZINA NA "LISTA DE IDA, DRFA E LMR PARA IFA COM USO AUTORIZADO" DO ANEXO I DA INSTRUÇÃO NORMATIVA Nº 51, DE 2019.
ANEXO II
INCLUSÃO DO IFA SOMATOTROPINA BOVINA RECOMBINANTE NA "LISTA DE IFA DE MEDICAMENTOS VETERINÁRIOS EM ALIMENTOS DE ORIGEM ANIMAL COM LMR NÃO NECESSÁRIO" DO ANEXO II DA INSTRUÇÃO NORMATIVA Nº 51, DE 2019.
|
IFA |
Espécie animal |
Nota |
|
SOMATOTROPINA BOVINA RECOMBINANTE (rBST) |
Bovino |
- Exclusivamente para fins zootécnicos. |
RESOLUÇÃO - RDC Nº 596, DE 2 DE FEVEREIRO DE 2022
Aprova a Errata nº 1 do Formulário de Fitoterápicos da Farmacopeia Brasileira, 2ª edição, de que trata a Resolução de Diretoria Colegiada - RDC nº 463, de 27 de janeiro de 2021.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, aliado ao art. 7º, III e IV da Lei nº 9.782, de 26 de janeiro de 1999, e ao art. 187, VI, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve adotar a seguinte Resolução de Diretoria Colegiada, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
Art. 1º Fica aprovada a Errata nº 1 do Formulário de Fitoterápicos da Farmacopeia Brasileira, 2ª edição, de que trata a Resolução de Diretoria Colegiada - RDC nº 463, de 27 de janeiro de 2021.
Art. 2º A Errata nº 1 será publicada e disponibilizada no portal da Anvisa, cujo acesso encontra-se disponível pelo endereço https://www.gov.br/anvisa/pt-br.
Art. 3º Esta Resolução entra em vigor no dia 2 de março de 2022.
ANTONIO BARRA TORRES
Diretor-Presidente
RESOLUÇÃO - RDC Nº 597, DE 2 DE FEVEREIRO DE 2022
Dispõe sobre as inspeções sanitárias de forma remota em bens e produtos importados sujeitos à vigilância sanitária.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso das atribuições que lhe confere o art. 15, III e IV, aliado ao art. 7º, III e IV da Lei nº 9.782, de 26 de janeiro de 1999, e ao art. 187, VI, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve adotar a seguinte Resolução de Diretoria Colegiada, conforme deliberado em reunião realizada em 1º de fevereiro de 2022, e eu, Diretor-Presidente, determino a sua publicação.
Art. 1º Esta Resolução dispõe sobre as inspeções sanitárias de forma remota em bens e produtos importados sujeitos à vigilância sanitária.
§ 1º O disposto no caput aplica-se a mercadorias classificadas de acordo com códigos da Nomenclatura Comum do Mercosul (NCM) sujeitos à anuência da Anvisa, mesmo que a finalidade declarada pelo importador não seja passível de intervenção sanitária.
§ 2º A inspeção de forma remota pode substituir a inspeção presencial, a critério da autoridade sanitária, em todas as modalidades de importação.
Art. 2º A inspeção sanitária de forma remota será realizada por meio de tecnologias de videoconferência contratadas pela Anvisa ou por sistemas específicos para essa finalidade disponibilizados pelos recintos alfandegados, que permitam:
I - agendamento de inspeção;
II - acesso via Internet;
III - transmissão de imagem em tempo real da inspeção;
IV -captura de imagens;
V - download dos arquivos resultantes da inspeção; e
VI - gravação da inspeção e posterior acesso à gravação.
Art. 3º A inspeção remota deve ocorrer em condições que:
I - não comprometam o estado e a conservação dos produtos;
II - proporcionem adequada visualização dos produtos inspecionados e da rotulagem com nitidez;
III - permitam a compreensão da voz e fala de todos os envolvidos na inspeção; e
IV - permitam a verificação das condições ambientais do local onde a inspeção está sendo realizada.
Art. 4º Durante a inspeção, compete ao funcionário do recinto alfandegado posicionar a câmera para captação e transmissão das imagens dos produtos inspecionados atendendo às instruções do servidor da Anvisa, que conduzirá a inspeção.
Parágrafo único. O recinto alfandegado deve disponibilizar funcionários em quantidade e qualificação adequadas para o posicionamento da carga, abertura e a exibição dos produtos na data e hora agendadas pela Anvisa para inspeção.
Art. 5º As instruções para organização e realização da inspeção remota serão registradas por meio de exigência no sistema integrado de comércio exterior (Siscomex), ou sistema equivalente que venha a substituí-lo.
§ 1º Quando solicitado, o importador deve anexar o comprovante de atracação da carga ao dossiê de importação.
§ 2º Cabe ao importador seguir as instruções da Anvisa e comparecer presencialmente à inspeção ou enviar representante devidamente autorizado por procuração.
Art. 6º Cabe ao fiel depositário de remessas expressas e postais internacionais seguir as instruções da Anvisa para a organização e a realização da inspeção sanitária de forma remota.
Art. 7º A inspeção sanitária de forma remota pode ser reagendada em casos excepcionais e de forma motivada, devido à ausência do representante do importador ou da não disponibilização das cargas.
Art. 8º O descumprimento ou inobservância no disposto nesta Resolução configura infração de natureza sanitária, nos termos da Lei nº 6.437, de 1977.
Art. 9º Esta Resolução entra em vigor em 2 de março de 2022.
ANTONIO BARRA TORRES
Diretor-Presidente
2ª DIRETORIA
GERÊNCIA-GERAL DE MEDICAMENTOS E PRODUTOS BIOLÓGICOS
RESOLUÇÃO-RE Nº 392, DE 7 DE FEVEREIRO DE 2022
O Gerente-Geral de Medicamentos e Produtos Biológicos, no uso das atribuições que lhe confere o art. 100, aliado ao art. 203, I, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve:
Art. 1º Publicar a aprovação condicional das petições secundárias de medicamentos similares, genéricos e novos, sob os números de expediente constantes no anexo desta Resolução, nos termos dos Arts. 4º, 5º, 6º e 7º da Resolução de Diretoria Colegiada - RDC nº 415, de 26 de agosto de 2020.
Art. 2º Este ato administrativo decorre do atendimento integral pelas empresas detentoras dos registros, ao disposto no Art. 5º, seus parágrafos e incisos, da Resolução de Diretoria Colegiada - RDC nº 415, de 26 de agosto de 2020.
Art. 3º A aprovação condicional das petições secundárias objeto desta Resolução é restrita ao assunto protocolado, não resultando em manifestação diversa da peticionada e considera estritamente a condição já registrada.
Art. 4º A empresa detentora do registro do medicamento objeto desta resolução deverá notificar a Gerência-Geral de Medicamentos e Produtos Biológicos na ocorrência do caso previsto no Art. 15 da Resolução de Diretoria Colegiada - RDC nº 415, de 26 de agosto de 2020.
Art. 5º Esta Resolução entra em vigor na data de sua publicação.
GUSTAVO MENDES LIMA SANTOS
ANEXO
NOME DA EMPRESA
NOME DO MEDICAMENTO NÚMERO DO PROCESSO
EXPEDIENTE PETIÇÃO 2ª ASSUNTO DA PETIÇÃO 2ª
EXPEDIENTE PETIÇÃO CLONE ASSUNTO PETIÇÃO CLONE
(ASSUNTO PETIÇÃO MATRIZ - EXPEDIENTE MATRIZ - PROCESSO MATRIZ)
---------------------------------------------------
ACHÉ LABORATÓRIOS FARMACÊUTICOS S.A
AXONIUM 25351757175201011
6996723217 SIMILAR - Inclusão de novo fabricante do IFA
7012709213 SIMILAR - Mudanças nos limites de especificação fora de limites aprovados anteriormente
OLANEXYN 25351858176201831
6996725213 SIMILAR - Inclusão de novo fabricante do IFA
7012707217 SIMILAR - Mudanças nos limites de especificação fora de limites aprovados anteriormente
OLANZAPINA 25351858178201821
6996721211 GENÉRICO - Inclusão de novo fabricante do IFA
6243704216 GENÉRICO - Mudanças nos limites de especificação fora de limites aprovados anteriormente
---------------------------------------------------
HIPOLABOR FARMACEUTICA LTDA
CLORIDRATO DE ONDANSETRONA 25351591404201608
8451382219 GENÉRICO - Inclusão de local de fabricação de medicamento estéril
8451393214 GENÉRICO - Mudanças maiores de métodos analíticos
---------------------------------------------------
UNIÃO QUÍMICA FARMACÊUTICA NACIONAL S/A
CLORIDRATO DE DEXMEDETOMIDINA 25351690647201499
0078851221 GENÉRICO - Inclusão maior de equipamento
EXTODIN 25351778267201461
0244312221 SIMILAR - Modificação Pós-Registro - CLONE
3ª DIRETORIA
GERÊNCIA-GERAL DE TECNOLOGIA DE PRODUTOS PARA SAÚDE
RESOLUÇÃO-RE Nº 393, DE 8 DE FEVEREIRO DE 2022
O Gerente-Geral de Tecnologia de Produtos para Saúde, no uso das atribuições que lhe confere o art. 121, aliado ao art. 203, I, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve:
Art. 1° Deferir as petições relacionadas à Gerência-Geral de Tecnologia de Produtos para a Saúde, conforme anexo.
Art. 2° O carregamento de instruções de uso no repositório documental de dispositivos médicos, disponível no portal da Anvisa, é obrigatório e deve ser executado pela empresa responsável pela regularização do produto, a qual consente que seu conteúdo guarda concordância com a legislação vigente e consistência com o produto regularizado, de acordo com o §4º do art. 3º da Resolução de Diretoria Colegiada - RDC nº 431, de 13 de outubro de 2020.
Parágrafo único. O carregamento citado no caput deverá ser realizado em até 30 (trinta) dias após a conclusão favorável da petição que implique mudança nas instruções de uso, de acordo com §6º do art. 3º da Resolução de Diretoria Colegiada - RDC nº 431, de 13 de outubro de 2020.
Art. 3° Esta Resolução entra em vigor na data de sua publicação.
LEANDRO RODRIGUES PEREIRA
ANEXO
NOME DA EMPRESA / CNPJ
NOME COMERCIAL
NUMERO DO PROCESSO / REGISTRO
PETIÇÃO(ÕES) / EXPEDIENTE(S)
_________________________________________________________________
_ _ _ _ _ _ _ _ _ _ _ _
CEPALAB LABORATÓRIOS LTDA / 02.248.312/0001-44
Família 2019 n-CoV Ag
25351.023722/2022-05 / 80258020130
8017 - IVD - Registro de produtos importados em família / 0179393224
RESOLUÇÃO-RE Nº 394, DE 8 DE FEVEREIRO DE 2022
O Gerente-Geral de Tecnologia de Produtos para Saúde, no uso das atribuições que lhe confere o art. 121, aliado ao art. 203, I, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve:
Art. 1° Indeferir as petições relacionadas à Gerência-Geral de Tecnologia de Produtos para a Saúde, conforme anexo.
Art. 2° O motivo do indeferimento do processo/petição será disponibilizado por meio de ofício eletrônico, encaminhado para a caixa postal da empresa solicitante no sistema Solicita, que pode ser acessado por meio do link: https://solicita.anvisa.gov.br/.
Art. 3º Esta Resolução entra em vigor na data de sua publicação.
LEANDRO RODRIGUES PEREIRA
ANEXO
NOME DA EMPRESA / CNPJ
NOME COMERCIAL
NUMERO DO PROCESSO / REGISTRO
PETIÇÃO(ÕES) / EXPEDIENTE(S)
_________________________________________________________________
_ _ _ _ _ _ _ _ _ _ _ _
ARGOSLAB DISTRIBUIDORA DE PRODUTOS PARA LABORATÓRIOS LTDA / 09.377.976/0001-52
QuickProfile COVID-19 ANTIGEN TEST Self-Testing
25351.052640/2022-60 /
8433 - IVD - Registro de produto / 0412229221
_ _ _ _ _ _ _ _ _ _ _ _
Diagmaster Científica ltda / 09.322.796/0001-73
Teste Humasis COVID-19 Home Test Ag
25351.052639/2022-35 /
8433 - IVD - Registro de produto / 0412226227
_ _ _ _ _ _ _ _ _ _ _ _
HI TECHNOLOGIES LTDA / 07.111.023/0001-12
AUTOTESTE COVID-19 ANTIGENO
25351.051470/2022-04 /
8433 - IVD - Registro de produto / 0404229228
_ _ _ _ _ _ _ _ _ _ _ _
KATAL BIOTECNOLOGICA INDÚSTRIA E COMÉRCIO LTDA / 71.437.917/0001-04
COVID-19 Ag Interkit
25351.038830/2022-74 /
8433 - IVD - Registro de produto / 0308779224
_ _ _ _ _ _ _ _ _ _ _ _
NUTRIEX IMPORTACAO E EXPORTACAO DE PRODUTOS NUTRICIONAIS E FARMOQUIMICOS LTDA / 06.172.459/0001-59
Família Autoteste Rápido Antígeno Covid-19 Swab Nasal Nutriex
25351.050331/2022-55 /
8017 - IVD - Registro de produtos importados em família / 0402294227
Autoteste Rápido Antígeno Covid-19 Swab Saliva Nutriex
25351.050330/2022-19 /
8017 - IVD - Registro de produtos importados em família / 0402288222
_ _ _ _ _ _ _ _ _ _ _ _
QR CONSULTING, IMPORTACAO E DISTRIBUICAO DE PRODUTOS MEDICOS LTDA / 19.933.144/0001-29
Teste Rápido de Antígeno COVID-19 (Fluido Oral)
25351.052637/2022-46 /
8017 - IVD - Registro de produtos importados em família / 0412220228
GERÊNCIA-GERAL DE TOXICOLOGIA
CONSULTA PÚBLICA N° 1.072, DE 3 DE FEVEREIRO DE 2022
O Gerente-Geral de Toxicologia, no exercício da competência que lhe foi delegada por meio do Despacho 153, de 27 de outubro de 2021, aliado ao art. 187, III, do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve submeter à consulta pública, para comentários e sugestões do público em geral, proposta de ato normativo, em Anexo.
Art. 1º Fica aberto, a contar da data de publicação desta Consulta Pública, o prazo de 60 (sessenta) dias para que sejam apresentadas críticas e sugestões relativas à proposta de Instrução Normativa que inclui o ingrediente ativo C84: Catolaccus grandis na Relação dos Ingredientes Ativos de Agrotóxicos, Saneantes Desinfestantes e Preservativos de Madeira, publicada por meio da Instrução Normativa - IN N° 103, de 19 de outubro de 2021.
Art. 2º A proposta supracitada estará disponível na íntegra no site da Anvisa, no endereço eletrônico https://www.gov.br/anvisa/pt-br e as sugestões deverão ser encaminhadas por escrito, em formulário próprio, para o endereço: Agência Nacional de Vigilância Sanitária, Gerência-Geral de Toxicologia, SIA Trecho 5, Área Especial 57, Brasília/DF, CEP 71.205-050; ou para o fax (61) 3462-5726; ou para o e-mail Este endereço de e-mail está protegido contra spambots. Você deve habilitar o JavaScript para visualizá-lo. .
§1° O formulário para envio de contribuições permanecerá à disposição dos interessados no endereço eletrônico http://antigo.anvisa.gov.br/consultas-publicas#.
§2° As contribuições recebidas serão públicas e permanecerão à disposição de todos no site da Anvisa.
§3° As contribuições não enviadas no formulário de que trata o parágrafo anterior ou recebidas fora do prazo não serão consideradas para efeitos de consolidação do texto final do regulamento.
Art. 3º Findo o prazo estipulado no art. 1º, a Agência Nacional de Vigilância Sanitária promoverá a análise das contribuições e, após a deliberação da Diretoria Colegiada, disponibilizará o resultado da consulta pública no site da Anvisa.
Parágrafo único. A Agência poderá, conforme necessidade e razões de conveniência e oportunidade, articular-se com os órgãos e entidades envolvidos e aqueles que tenham manifestado interesse na matéria para subsidiar posteriores discussões técnicas e deliberação final da Diretoria Colegiada
CARLOS ALEXANDRE OLIVEIRA GOMES
CONSULTA PÚBLICA N° 1.073, DE 3 DE FEVEREIRO DE 2022
O Gerente-Geral de Toxicologia, no exercício da competência que lhe foi delegada por meio do Despacho 153, de 27 de outubro de 2021, aliado ao art. 187, III, do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve submeter à consulta pública, para comentários e sugestões do público em geral, proposta de ato normativo, em Anexo.
Art. 1º Fica aberto, a contar da data de publicação desta Consulta Pública, o prazo de 60 (sessenta) dias para que sejam apresentadas críticas e sugestões relativas à proposta de Instrução Normativa que inclui o ingrediente ativo C85: Cinnamomum verum e C85.1: óleo essencial de Cinnamomum verum na Relação dos Ingredientes Ativos de Agrotóxicos, Saneantes Desinfestantes e Preservativos de Madeira, publicada por meio da Instrução Normativa - IN N° 103, de 19 de outubro de 2021.
Art. 2º A proposta supracitada estará disponível na íntegra no site da Anvisa, no endereço eletrônico https://www.gov.br/anvisa/pt-br e as sugestões deverão ser encaminhadas por escrito, em formulário próprio, para o endereço: Agência Nacional de Vigilância Sanitária, Gerência-Geral de Toxicologia, SIA Trecho 5, Área Especial 57, Brasília/DF, CEP 71.205-050; ou para o fax (61) 3462-5726; ou para o e-mail Este endereço de e-mail está protegido contra spambots. Você deve habilitar o JavaScript para visualizá-lo. .
§1° O formulário para envio de contribuições permanecerá à disposição dos interessados no endereço eletrônico http://antigo.anvisa.gov.br/consultas-publicas#.
§2° As contribuições recebidas serão públicas e permanecerão à disposição de todos no site da Anvisa.
§3° As contribuições não enviadas no formulário de que trata o parágrafo anterior ou recebidas fora do prazo não serão consideradas para efeitos de consolidação do texto final do regulamento.
Art. 3º Findo o prazo estipulado no art. 1º, a Agência Nacional de Vigilância Sanitária promoverá a análise das contribuições e, após a deliberação da Diretoria Colegiada, disponibilizará o resultado da consulta pública no site da Anvisa.
Parágrafo único. A Agência poderá, conforme necessidade e razões de conveniência e oportunidade, articular-se com os órgãos e entidades envolvidos e aqueles que tenham manifestado interesse na matéria para subsidiar posteriores discussões técnicas e deliberação final da Diretoria Colegiada.
CARLOS ALEXANDRE OLIVEIRA GOMES
CONSULTA PÚBLICA N° 1.074, DE 3 DE FEVEREIRO DE 2022
O Gerente-Geral de Toxicologia, no exercício da competência que lhe foi delegada por meio do Despacho 153, de 27 de outubro de 2021, aliado ao art. 187, III, do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, resolve submeter à consulta pública, para comentários e sugestões do público em geral, proposta de ato normativo, em Anexo.
Art. 1º Fica aberto, a contar da data de publicação desta Consulta Pública, o prazo de 60 (sessenta) dias para que sejam apresentadas críticas e sugestões relativas à proposta de Instrução Normativa que inclui o ingrediente ativo I31: Isaria javanica na Relação dos Ingredientes Ativos de Agrotóxicos, Saneantes Desinfestantes e Preservativos de Madeira, publicada por meio da Instrução Normativa - IN N° 103, de 19 de outubro de 2021.
Art. 2º A proposta supracitada estará disponível na íntegra no site da Anvisa, no endereço eletrônico https://www.gov.br/anvisa/pt-br e as sugestões deverão ser encaminhadas por escrito, em formulário próprio, para o endereço: Agência Nacional de Vigilância Sanitária, Gerência-Geral de Toxicologia, SIA Trecho 5, Área Especial 57, Brasília/DF, CEP 71.205-050; ou para o fax (61) 3462-5726; ou para o e-mail Este endereço de e-mail está protegido contra spambots. Você deve habilitar o JavaScript para visualizá-lo. .
§1° O formulário para envio de contribuições permanecerá à disposição dos interessados no endereço eletrônico http://antigo.anvisa.gov.br/consultas-publicas#.
§2° As contribuições recebidas serão públicas e permanecerão à disposição de todos no site da Anvisa.
§3° As contribuições não enviadas no formulário de que trata o parágrafo anterior ou recebidas fora do prazo não serão consideradas para efeitos de consolidação do texto final do regulamento.
Art. 3º Findo o prazo estipulado no art. 1º, a Agência Nacional de Vigilância Sanitária promoverá a análise das contribuições e, após a deliberação da Diretoria Colegiada, disponibilizará o resultado da consulta pública no site da Anvisa.
Parágrafo único. A Agência poderá, conforme necessidade e razões de conveniência e oportunidade, articular-se com os órgãos e entidades envolvidos e aqueles que tenham manifestado interesse na matéria para subsidiar posteriores discussões técnicas e deliberação final da Diretoria Colegiada
CARLOS ALEXANDRE OLIVEIRA GOMES
4ª DIRETORIA
GERÊNCIA-GERAL DE INSPEÇÃO E FISCALIZAÇÃO SANITÁRIA
RESOLUÇÃO-RE Nº 396, DE 8 DE FEVEREIRO DE 2022
A Gerente-Geral de Inspeção e Fiscalização Sanitária, Substituta, no uso das atribuições que lhe confere o art. 140, aliado ao art. 203, I, § 1º do Regimento Interno aprovado pela Resolução de Diretoria Colegiada - RDC nº 585, de 10 de dezembro de 2021, e o art. 6º, da Lei nº 9.782, de 26 de janeiro de 1999, resolve:
Art. 1º Adotar a(s) medida(s) preventiva(s) constante(s) no ANEXO.
Art. 2º Esta Resolução entra em vigor na data de sua publicação.
ALESSANDRA PAIXÃO DIAS
ANEXO
Empresa: KAMPO DE ERVAS INDÚSTRIA E COMÉRCIO LTDA - CNPJ: 08.898.383/0001-79
Produto - (Lote): CHÁ HARMONIA NOITE (FOLHAS DE MARACUJÁ)(TODOS);CHÁ MISTO ESPARTILHO(TODOS);CHÁ DE ALFAZEMA (FLOR DE LAVANDULA OFFICINALIS)(TODOS);CHÁ DE ARNICA DE JARDIM (SOLIDAGO MICROGLOSSA)(TODOS);CHÁ DE ARRUDA (RUTA GRAVEOLENS)(TODOS);CHÁ DE AROEIRA (SCHINUS TEREBINTHIFOLIUS)(TODOS);CHÁ DE BARBATIMÃO (STRYPHNODENDRON ADSTRINGENS)(TODOS);CHÁ DE BARDANA (ARCTIUM LAPPA)(TODOS);CHÁ DE CABELO DE MILHO (ZEA MAYS)(TODOS);CHÁ DE CANELA DE VELHO (MICONIA ALBICANS)(TODOS);CHÁ DE CÁSCARA SAGRADA (RHAMNUS PURSHIANA)(TODOS);CHÁ DE CAVALINHA (EQUISETUM ARVENSIS)(TODOS);CHÁ DE CAROBINHA (JACARANDA BRASILIENSIS)(TODOS);CHÁ DE CASTANHA DA ÍNDIA (AESCULLUS HIPPOCASTANUM)(TODOS);CHÁ DE CENTELLA ASIATICA (CENTELLA ASIATICA)(TODOS);CHÁ DE CHAPÉU DE COURO (ECHINODORUS MACROPHYLLUS)(TODOS);CHÁ DE CIPÓ PRATA (BANISTERIA ARGYROPHYLA)(TODOS);CHÁ DE DENTE DE LEÃO (TARAXACUM OFFICINALIS)(TODOS);CHÁ DE EMBAÚBA (CECROPIA SP.)(TODOS);CHÁ DE ERVA DE BICHO (POLYGONUM HIDROPIPEROIDES)(TODOS);CHÁ DE EQUINÁCEA (ECHINACEA PURPUREA)(TODOS);CHÁ DE GUAÇATONGA (CASEARIA SYLVESTRIS)(TODOS);CHÁ DE HORTELÃ (MENTHA CRISPA)(TODOS);CHÁ DE JURUBEBA (SOLANUM PANICULATUM)(TODOS);CHÁ DE MELÃO DE SÃO CAETANO (MOMORDICA CHARANTHIA)(TODOS);CHÁ DE MULUNGU (ERYTHRINA MULUNGU)(TODOS);CHÁ DE OLIVEIRA (OLEA EUROPEA)(TODOS);CHÁ DE POEJO (MENTHA PULEGGIUM)(TODOS);CHÁ DE PORANGABA (CORDIA SALICIFOLIA)(TODOS);CHÁ DE QUEBRA-PEDRA (PHYLLANTUS NIRURI)(TODOS);CHÁ DE QUINA QUINA (CINCHONA OFFICINALIS)(TODOS);CHÁ DE ROMÃ (CASCA DE PUNICA GRANATUM)(TODOS);CHÁ DE SALSAPARRILHA (SMILAX SP.)(TODOS);CHÁ DE SENE (FOLHA OU FOLÍCULO DE CASSIA ANGUSTIFOLIA)(TODOS);CHÁ DE SUCUPIRA (PTERODON EMARGINATUS)(TODOS);CHÁ DE TANCHAGEM (PLANTAGO LANCEOLATA)(TODOS);CHÁ DE UNHA DE GATO (UNCARIA TOMENTOSA)(TODOS);CHÁ DE UXI AMARELO (ENDOPLEURA UCHI)(TODOS);CHÁ DE UVA URSI (ARCTOSTAPHYLOS UVA-URSI)(TODOS);CHÁ DE ESPINHEIRA SANTA (MAYTENUS ILICIFOLIA)(TODOS);CHÁ SETE SANGRIAS (CUPHEA BALSAMONA)(TODOS);CHÁ MISTO DESPACHÁ (DENTE DE LEÃO E ESPINHEIRA SANTA)(TODOS);CHÁ DE ABACATE (FOLHAS DE PERSEA AMERICANA) (TODOS);CHÁ DE ALCACHOFRA (CYNARA SCOLIMUS)(TODOS);CHÁ DE ALECRIM DO CAMPO (BACCHARIS DRACUNCULIFOLIA)(TODOS);CHÁ DE AMORA (FOLHAS DE MORUS NIGRA)(TODOS);CHÁ DE ARNICA DE JARDIM (SOLIDAGO MICROGLOSSA) (TODOS);CHÁ DE ASSA PEIXE (VERNONIA POLYANTHES)(TODOS);CHÁ DE BABOSA (ALOE VERA)(TODOS);CHÁ DE CAAPEBA (POTHOMORPHE UMBELLATA) (TODOS);CHÁ DE CALÊNDULA (CALENDULA OFFICINALIS)(TODOS);CHÁ DE CRAJIRÚ (ARRABIDEA CHICA) (TODOS);CHÁ DE ECLIPTA (ERVA BOTÃO)(TODOS);CHÁ DE EMBAUBA (CECROPIA PELTATA)(TODOS);CHÁ DE ERVA BALEEIRA (CORDIA VERBENACEA)(TODOS);CHÁ DE ERVA DE BICHO (POLYGONUM HIDROPIPEROIDES)(TODOS);CHÁ DE ERVA SANTA MARIA (CHENOPODIUM AMBROSIOIDES)(TODOS);CHÁ DE FÁFIA (PFAFFIA GLOMERATA - GINSENG BRASILEIRO)(TODOS);CHÁ DE GOIABA (FOLHAS DE PSIDIUM GUAJAVA)(TODOS);CHÁ DE GUACO (MIKANIA GLOMERATA) (TODOS);CHÁ DE GUINÉ (PETIVERIA ALLIACEA) (TODOS);CHÁ DE JAMBOLÃO (SYZGIUM JAMBOLANAUM)(TODOS);CHÁ DE LIPIA (LIPPIA ALBA)(TODOS);CHÁ DE LEVANTE (MENTHA VIRIDI)(TODOS);CHÁ DE LOSNA (ARTEMISIA ABSINTHIUM)(TODOS);CHÁ DE MACELA (ACHYROCLINE SATUREIOIDES) (TODOS);CHÁ DE MANGA (FOLHAS DE MANGIFERA INDICA) (TODOS);CHÁ DE MARACUJÁ (FOLHAS DE PASSIFLORA EDULIS) (TODOS);CHÁ DE MENTRASTO (AGERATUM CONYZOIDES) (TODOS);CHÁ DE PATA DE VACA (BAUHINIA FORFICATA) (TODOS);CHÁ DE PICÃO PRETO (BIDENS PILOSA)(TODOS);CHÁ DE ZEDOÁRIA (CURCUMA ZEDOARIA) (TODOS);
Tipo de Produto: Alimento
Expediente nº: 0260628/22-3
Assunto: 70351 - Ações de Fiscalização em Vigilância Sanitária
Ações de fiscalização: Proibição - Comercialização, Distribuição, Fabricação, Propaganda, Uso, Recolhimento
Motivação: Considerando os arts. 2º, 45, 46 e 56 do Decreto-lei nº 986, de 21 de outubro de 1969; o inciso XV, art. 7º e o inciso II, § 1º, art. 8º da Lei nº 9.782, de 26 de janeiro de 1999; a Resolução - RDC nº 24, de 08 de junho de 2015; e a comprovação da fabricação e comercialização de chás contendo espécies vegetais ou partes não autorizadas nesta categoria de alimentos. Foram infringidos os seguintes dispositivos legais: inc. IV do art. 48 do Decreto-Lei nº 986, de 21 de outubro de 1969; item 2.2 da Resolução - RDC 277, de 22 de setembro de 2005; Resolução - RDC nº 267, de 22 de setembro de 2005 - que estabelece as espécies vegetais para o preparo de chás e exclui as espécies vegetais com finalidade medicamentosa ou terapêutica, alterada pela Resolução - RDC nº 219, de 22 de dezembro de 2006 e Resolução - RDC nº 450, de 16 de dezembro de 2020.
(DOU de 09.02.2022 - págs. 145 a 149 - Seção 1)


