Anvisa alerta sobre falsificação do medicamento Ozempic®
Saiba como identificar os produtos falsificados.
A Anvisa recebeu um comunicado da empresa responsável pelo produto biológico Ozempic® (semaglutida) – Novo Nordisk Farmacêutica do Brasil Ltda. – sobre indícios de que canetas de insulina Fiasp® FlexTouch® foram readesivadas e reaproveitadas com rótulos de Ozempic® do lote NP5K174, que possivelmente foram retirados indevidamente de canetas originais do medicamento.
Ou seja, o lote NP5K174 é um lote original e autêntico de Ozempic, mas os seus rótulos teriam sido usados em embalagens de insulina vendidas como Ozempic em uma fraude que ainda segue em investigação.
Orientações gerais à população e aos profissionais de saúde
A Anvisa orienta que a população e os profissionais de saúde fiquem atentos às características da embalagem e do produto, e que adquiram somente produtos completos (dentro da caixa), em farmácias regularizadas junto à Vigilância Sanitária e sempre com a emissão de nota fiscal.
Desconfie de sites e canais para comercialização de medicamentos que usam os nomes das marcas ou que adotam aplicativos de vendas e redes sociais para ofertar os produtos, e não adquira medicamentos oferecidos em grupos de mensagens.
A empresa Novo Nordisk emitiu um comunicado (veja o texto completo aqui) com orientações para se proteger de casos de falsificação, na hora da compra.
Confira as principais indicações de fraude, de acordo com as informações disponibilizadas pela empresa:
- • A caneta de Ozempic® é de cor azul clara, com o botão de aplicação cinza. Já canetas de insulina Fiasp® são de cor azul escura, com botão laranja.
- • Embalagem do medicamento rasurada ou visivelmente alterada, em idioma estrangeiro, com aparência farmacêutica (apresentação) diferente da registrada e com informações incorretas sobre o produto – o Ozempic® 1mg é vendido apenas em canetas pré-preenchidas injetáveis.
- • Preços muito abaixo dos praticados no mercado regular de farmácias e drogarias.
- • Adesivos e indicações de “nova fórmula” ou informações semelhantes – a Novo Nordisk não lançou nenhuma nova fórmula de Ozempic® desde sua chegada ao mercado, em 2019.
- • Canetas de Ozempic® 1mg com numerações no seletor de dose diferentes de 0mg e 1mg.
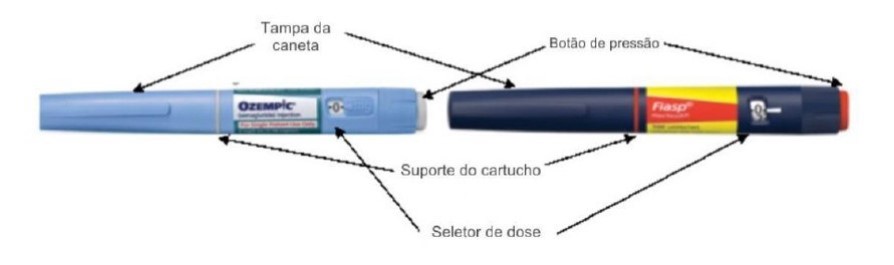
Conforme o comunicado da empresa, em caso de dúvidas sobre os pontos de venda ou caso sejam identificadas unidades dos medicamentos com suspeita de falsificação, a população ou os profissionais de saúde não devem utilizar o produto e devem entrar em contato com o Serviço de Atendimento ao Consumidor (SAC) da Novo Nordisk, de segunda a sexta-feira, das 8h às 17h, pelo telefone 0800 014 44 88, ou 24 horas pelo e-mail: sac.br@novonordisk.com.
Além disso, o fato deve ser comunicado imediatamente à Anvisa. A comunicação pode ser feita pela Ouvidoria da Anvisa (https://www.gov.br/anvisa/pt-br/canais_atendimento/ouvidoria) ou pelo link https://www.gov.br/anvisa/pt-br/assuntos/fiscalizacao-e-monitoramento/notificacoes/vigimed/
Anvisa publica lista de empresas que podem fabricar ou importar dispositivos médicos sob medida
Medida está prevista na nova resolução sobre dispositivos médicos personalizados.
A Anvisa publicou, nesta terça-feira (29/10), a lista de empresas autorizadas a fabricar ou importar dispositivos médicos sob medida.
A publicação da lista está prevista na Resolução da Diretoria Colegiada (RDC) 925/2024, publicada em 19 de setembro de 2024, que trata dos requisitos para fabricação, comercialização, importação e exposição ao uso de dispositivos médicos personalizados.
Saiba mais abaixo. Acesse aqui a lista das empresas autorizadas a fabricar ou importar dispositivos médicos sob medida.
O que são dispositivos médicos personalizados?
É qualquer um dos três tipos de dispositivos médicos que se destinam a um indivíduo em particular: dispositivo médico sob medida, dispositivo médico paciente-específico ou dispositivo médico adaptável.
Os dispositivos médicos adaptáveis e os dispositivos médicos paciente-específicos precisam de registro na Anvisa. Já os dispositivos médicos sob medida possuem um processo diferente de regularização:
- A empresa deve enviar para a Agência o pedido (peticionamento) para fabricar ou importar dispositivos médicos contemplados nas classes de risco III e IV, para cada unidade fabril, contendo as informações previstas no art. 9º da RDC 925/2024.
- A Anvisa irá analisar o pedido e verificar se a empresa atende aos critérios exigidos. Após a análise, será publicada no Diário Oficial da União a lista de empresas autorizadas e será enviado um ofício eletrônico para a caixa postal da empresa, comunicando a decisão.
- Depois da aprovação, a empresa deve protocolar uma petição de notificação de fabricação ou importação de dispositivo médico sob medida (classes III e IV) para cada paciente e cada dispositivo médico sob medida. A petição deve ser vinculada à petição inicial de anuência. As notificações deverão conter as informações previstas no art. 10 da RDC 925/ 2024 e não necessitarão de aprovação prévia da Anvisa para serem implementadas pela empresa.
Orientações para empresas
A consulta aos expedientes de anuência da empresa e de notificação de cada um dos dispositivos médicos sob medida anuídos pode ser feita pelo Portal de Consultas>Situação de Documentos >Técnico.
Para adicionar segurança ao processo de notificação de dispositivos médicos sob medida, a Anvisa passou, a partir do último dia 25 de outubro, a monitorar as notificações enviadas pelas empresas. Após essa verificação, os processos que estiverem corretamente instruídos serão considerados “anuídos” e os que apresentarem não conformidades serão “não anuídos”.
Os motivos da não anuência da notificação serão comunicados para a empresa por meio de envio de ofício eletrônico para a sua caixa postal.
Anvisa sedia o I Summit Ciência e Inovação Regulatória
O evento discutiu as tendências internacionais, considerando o contexto brasileiro.
Na sexta-feira (25/10), a Anvisa sediou, no auditório de sua sede em Brasília (DF), o I Summit Ciência e Inovação Regulatória. Realizado em parceria com a Associação da Indústria Farmacêutica de Pesquisa (Interfarma), o encontro foi também transmitido ao vivo pela internet e abordou temas como saúde digital, inteligência artificial e, ainda, os desafios e as inovações no campo regulatório global. Segundo a diretora de Política Regulatória e Inteligência da Interfarma e uma das mediadoras do evento, Luciana Takara, um dos principais objetivos foi discutir as tendências internacionais, considerando o contexto brasileiro.
O Summit contou com a presença de diretores e servidores da Anvisa, além de representantes do Ministério da Saúde (MS), da Interfarma e de laboratórios farmacêuticos do setor privado. Especialistas do Brasil e de outros países se reuniram para compartilhar conhecimentos e experiências.
Governança, interoperabilidade e futuro
A governança de dados, que abrange um conjunto de práticas, processos e estruturas para garantir a gestão eficaz e responsável de informações em uma organização, foi destaque nos debates do dia. O coordenador-geral de Disseminação e Integração de Dados e Informações em Saúde do MS, Thiago Fontana, mencionou a importância da qualidade dos dados coletados e organizados, ressaltando que a informação é fundamental para decisões mais seguras. “Precisamos compreender quais são as informações mais relevantes em um processo gerencial”, enfatizou.
Thiago Fontana apresentou ao público exemplos de iniciativas do governo, como o Plano de Dados Abertos (PDA), que planeja ações para a abertura e manutenção de dados nas organizações públicas e operacionaliza a Política de Dados Abertos do Poder Executivo Federal. Outro exemplo citado foi o Conecte SUS, que disponibiliza um conjunto integrado de informações em saúde do país. Essa ferramenta materializa também a Estratégia de Saúde Digital para o Brasil 2020-2028 (ESD28), que busca sistematizar e consolidar o trabalho realizado ao longo da última década, refletido em diversos documentos – buscando, assim, a troca de informações de saúde entre todos os pontos da rede de atenção em saúde, tanto pública quanto privada.
Dessa maneira, a questão da interoperabilidade foi outro assunto relevante do evento, uma vez que é um conceito que diz respeito à integração entre diferentes sistemas e plataformas, de modo autônomo. Para o gerente de Data Science da companhia farmacêutica Boehringer, Pedro Tosta, a governança garante que uma informação transite da maneira correta, enquanto a interoperabilidade é “um grande potencializador de futuros”, ao lado de tecnologias emergentes, visto que permite o aprimoramento de iniciativas de saúde digital, ao democratizar informações de saúde para pacientes, profissionais e instituições.
O titular da Gerência-Geral de Medicamentos (GGMED) da Anvisa, Nélio Aquino, abordou desafios que se colocam no contexto regulatório, debatendo soluções de interoperabilidade como o eCTD (electronic common technical document – documento técnico comum eletrônico), um padrão estruturado para a submissão de dossiês de registro de medicamentos em formato físico e eletrônico. Outra solução mencionada pelo gerente-geral envolve projetos estratégicos como a Norma ISO IDMP (Identification of Medicinal Products), idealizada pela Organização Internacional de Normalização (International Organization for Standardization – ISO), que visa harmonizar a forma como os medicamentos são identificados em diferentes países e regiões.
Para Nélio Aquino, o futuro da farmacovigilância está diretamente relacionado ao futuro da submissão de informações. “Hoje, recebemos documentos eletrônicos, mas são informações não estruturadas. Precisamos evoluir no sentido de automatizar essa estruturação”, ressaltou. “Confiança regulatória é algo que todos buscam, não apenas as agências, mas também a própria indústria. Essa confiança passa pela adoção de novas tecnologias, padrões e estruturas de dados”, acrescentou.
Cooperação internacional em prol da saúde do cidadão
Além de debater amplamente o uso de plataformas de tecnologia da informação (TI) para a otimização de processos regulatórios, o evento discutiu, ainda, o worksharing, um método que permite que diferentes pessoas trabalhem simultaneamente em um mesmo modelo de projeto. As perspectivas da indústria sobre o uso de inteligência artificial no desenvolvimento de produtos e a convergência global de abordagens regulatórias foram outros temas tratados no encontro.
Entre esses variados tópicos de grande relevância, o que uniu todas as iniciativas foi o impacto direto da cooperação internacional no acesso a medicamentos para o cidadão, ressaltando a importância de um trabalho conjunto para a melhoria da saúde pública. Desse modo, como ressaltou Nélio Aquino, a partir do debate sobre ferramentas, tecnologias ou processos, questões serão amadurecidas e validadas. Contudo, para todos os palestrantes do dia, o fator humano continua sendo fundamental em qualquer decisão.
Fonte: Anvisa, em 29.10.2024.


