Anvisa participa de missão oficial à Nigéria e debate cooperação estratégica em saúde
Agência integrou comitiva oficial do Brasil ao país africano.
Nos dias 24 e 25 de junho, a Anvisa, representada pelo diretor-presidente substituto Rômison Rodrigues Mota, integrou a comitiva oficial do governo brasileiro na segunda sessão do Mecanismo de Diálogo Estratégico Brasil–Nigéria, realizada em Abuja, capital nigeriana.
A missão foi copresidida pelo vice-presidente do Brasil, Geraldo Alckmin, e pelo vice-presidente da Nigéria, Kashim Shettima. O evento teve como objetivo fortalecer a parceria entre os dois países em áreas prioritárias como saúde, agricultura, comércio, segurança, energia e educação.
Representando a Anvisa, Rômison Mota participou do painel “Cooperation in Strategic Sectors”, voltado à discussão de estratégias conjuntas para ampliar a colaboração internacional em temas regulatórios e de fortalecimento dos sistemas de saúde. A presença da Agência reforça o compromisso do Brasil com a cooperação Sul-Sul e com o fortalecimento da regulação sanitária como instrumento de promoção da saúde e do desenvolvimento.
Além da Anvisa, a comitiva brasileira contou com a participação de representantes dos ministérios das Relações Exteriores, Defesa, Agricultura e Pecuária, Turismo, Indústria e Comércio, entre outros órgãos, como a Fundação Palmares, a Agência Nacional do Cinema (Ancine), o Banco Nacional de Desenvolvimento Econômico e Social (BNDES) e o Serviço Federal de Processamento de Dados (Serpro). Também integraram a delegação a ministra da Igualdade Racial, Anielle Franco, e a deputada federal Benedita da Silva.

Diretor Romison participa de painel com tema “Cooperation in Strategic Sectors”

Delegação brasileira na visita oficial à Nigéria
Confira as melhorias na forma de emissão de certidões e certificados de produtos registrados e notificados
Está em curso a transformação digital do fluxo de emissão de certidões e certificados, que passará a ser totalmente eletrônico e por autosserviço!
A Anvisa deu início à transformação digital da emissão de certidões e certificados de produtos registrados e notificados sujeitos à regulação sanitária. O primeiro serviço que contará com essa automatização será o de emissão de certidões e certificados exclusivos para exportação da área de Cosméticos, a partir desta quinta-feira (26/6). A emissão eletrônica dos demais tipos de certidões ou certificados de Cosméticos será disponibilizada no próximo mês de julho.
As melhorias visando o autosserviço serão gradativamente implementadas para a emissão de certidões e certificados dos outros tipos de produtos, ao longo de 2025. É importante registrar que as formas vigentes atualmente não serão alteradas e que esta é mais uma opção de peticionamento.
Entenda o passo a passo
A emissão será feita de maneira totalmente automática, por meio de uma nova opção do sistema Solicita.
Na tela inicial de “Peticionamento”, na opção “Rascunho” do menu, ao clicar em “Novo” será apresentada a nova opção “Solicitar Certidão/Certificado”.
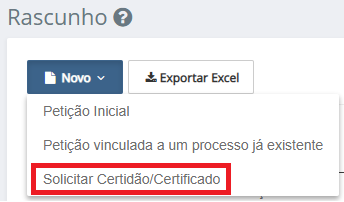
Tela inicial
Uma nova tela será exibida com os dados da empresa e do usuário que a está representando. Clicando na lupa da seção Tipo de Solicitação, será exibido um campo para que o usuário selecione para qual produto quer emitir o documento.
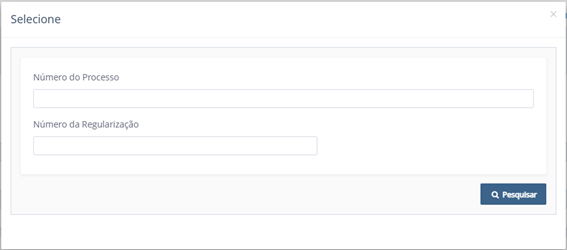
Imagem 2 - numero do processo
Após a seleção do processo desejado, o usuário deverá escolher o tipo de documento:
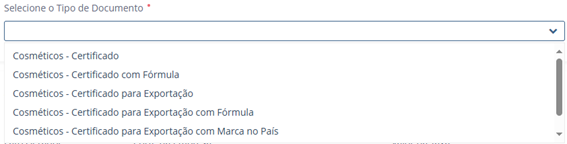
Imagem 3 - tipo de documento
Após a escolha, o sistema informará o valor da taxa e permitirá que o usuário pré-visualize a certidão ou certificado que será emitido.
IMPORTANTE: Caso seja identificada qualquer incongruência nas informações do documento a ser emitido, entre em contato com a área responsável pelo produto. Uma vez emitido o documento, não será possível alterá-lo.
Para concluir a emissão, clique em “Enviar”. O certificado será emitido automaticamente se não houver a necessidade de pagamento de taxa ou logo após o sistema fazer a conciliação bancária quando houver a necessidade desse pagamento.
Informações detalhadas sobre o processo de emissão do certificado estão disponíveis no Manual do Solicita.
Como acessar a certidão ou certificado após a emissão do documento
Para acessar o documento, o usuário deverá acessar a aba de processos:
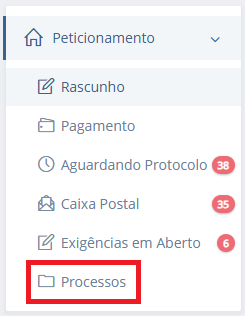
Imagem 4 - acessar documento
A seguir, o usuário deverá acessar o processo do produto e identificar o expediente de solicitação de certidão ou certificado:
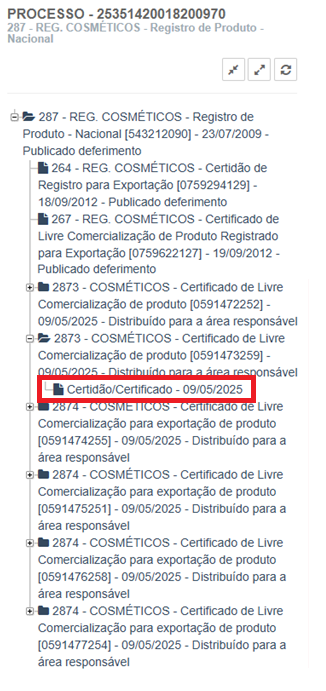
Imagem 5 -Expediente
Como validar a certidão ou certificado recebido
A validação poderá ser feita por meio do sistema de consultas externas da Anvisa, na opção Validação de Documentos:
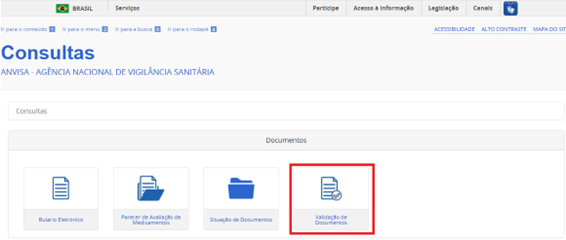
Imagem 6 - Consultas
A tela de validação vai exigir o preenchimento de três informações: data de emissão, código e hash. Todas elas constam da assinatura eletrônica no rodapé de todas as páginas do documento:

Imagem 7 - assinatura
Alternativamente, ao escanear o QR Code, o usuário será direcionado automaticamente para a tela de validação, já com as informações preenchidas para aquele documento.
Se a validação for bem-sucedida – ou seja, se o produto não tiver sido modificado, ainda estiver na validade do registro e não tiver sido cancelado –, o sistema mostrará que o documento está válido e exibirá o PDF novamente para download logo abaixo:

Imagem 8 - documento válido
Caso o documento estiver desatualizado, ou se o produto estiver “caduco” ou vencido, ou, ainda, se o produto tiver sido cancelado, o sistema informará em vermelho a situação e o documento NÃO será exibido:
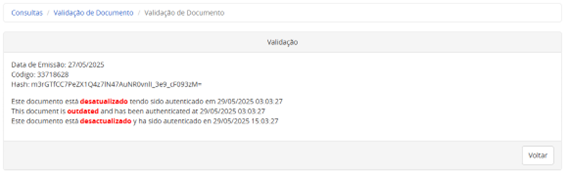
Imagem 9 - documento inválido
Anvisa recebe 3º Workshop de Produtos Biológicos e Biossimilares
Especialistas do Brasil e do exterior discutiram avanços regulatórios e técnico-científicos de produtos biológicos e biossimilares.
Nos dias 24 e 25 de junho, o auditório da Anvisa, em Brasília (DF), sediou o 3º Workshop de Produtos Biológicos e Biossimilares. O evento foi realizado em parceria com a U.S. Pharmacopeia (USP) e com o Sindicato da Indústria de Produtos Farmacêuticos (Sindusfarma), com o objetivo de promover debates sobre os avanços regulatórios e técnico-científicos no campo dos produtos biológicos e biossimilares.
Ao longo dos dois dias do evento, 180 participantes acompanharam uma programação abrangente, repleta de debates e análises sobre os desafios enfrentados pela indústria farmacêutica, assim como as tendências e oportunidades que se desenham no cenário atual.
Foram discutidas questões relacionadas à qualidade, segurança e eficácia dos produtos biológicos e biossimilares, com ênfase nos desafios práticos, além da apresentação de experiências internacionais sobre abordagens técnicas e regulatórias para o desenvolvimento pela via da comparabilidade.
Durante o evento, também foi anunciado o convite feito à Anvisa para ocupar a posição de Regulatory chair do grupo de trabalho para discussão sobre a utilidade dos estudos comparativos de eficácia no desenvolvimento de biossimilares, recém-criado no âmbito do ICH (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use - Conselho Internacional de Harmonização de Requisitos Técnicos para Produtos Farmacêuticos de Uso Humano).
Trata-se de uma posição-chave, responsável pela liderança técnica e regulatória do grupo, pela coordenação das discussões e pela busca de consenso entre os seus membros e harmonização internacional dos requisitos técnicos. Esta indicação é um reconhecimento da capacidade dos técnicos da Agência e da importância da sua posição no cenário farmacêutico mundial.
Troca de experiências em prol de medicamentos seguros
Os participantes tiveram a oportunidade de participar de apresentações de especialistas em temas como segurança e eficácia de anticorpos monoclonais e métodos analíticos avançados utilizados para a caracterização dessas moléculas.
Também foram abordados temas como bioensaios e soluções compendiais (métodos, padrões e especificações de qualidade estabelecidos por farmacopeias oficiais, como a USP), fundamentais para o controle de qualidade e o desenvolvimento eficiente de biossimilares.
O evento também contou com apresentação de estudos de casos e sessões interativas de perguntas e respostas, favorecendo o diálogo entre especialistas, reguladores e representantes da indústria. Essa troca de experiências contribuiu para o fortalecimento do ambiente regulatório, para o avanço do setor farmacêutico no Brasil e para a oferta de produtos biológicos e biossimilares desenvolvidos com segurança, qualidade e eficácia.
Veja as fotos do evento.
Fonte: Anvisa, em 26.06.2025.


