Instabilidade no formulário da Declaração de Saúde do Viajante
A Agência já está atuando para estabilizar o sistema o mais breve possível.
O formulário da Declaração de Saúde do Viajante tem apresentado instabilidade. A Agência já está atuando para estabilizar o sistema o mais breve possível.
As companhias aéreas já foram comunicadas pelas autoridades brasileiras, e a fim de que não haja qualquer prejuízo aos viajantes, os embarques de passageiros internacionais com destino ao Brasil ocorrerão sem a exigência de apresentação da DSV.
A Anvisa pede desculpas por eventuais transtornos.
Acompanhe a 23ª Reunião da Diretoria Colegiada da Anvisa
Na pauta, temas como cruzeiros marítimos, Sistema Nacional de Controle de Medicamentos (SNCM) e boas práticas de fabricação de medicamentos, entre outros.
23ª Reunião Ordinária Pública da Diretoria Colegiada da Anvisa
Data: 25/11/2021, quinta-feira.
Horário: 9h30.
A Anvisa realiza, a partir das 9h30 desta quinta-feira (25/11), a 23ª Reunião Ordinária Pública da Diretoria Colegiada (Dicol). O encontro dos diretores será realizado por meio de videoconferência, conforme o Decreto 10.416/2020, e você pode acompanhá-lo ao vivo pelo canal da Agência no YouTube.
Durante a reunião, a Diretoria irá avaliar a proposta de abertura de processo regulatório e a proposta de Instrução Normativa (IN) para alterar a IN 100/2021, que estabelece os medicamentos sujeitos ao Sistema Nacional de Controle de Medicamentos (SNCM) e os prazos para serialização e para início da comunicação de registros de instâncias de eventos.
A pauta traz também a proposta de abertura de processo regulatório e a proposta de Resolução da Diretoria Colegiada (RDC) para alterar a RDC 574/2021, que dispõe sobre os requisitos sanitários para o embarque, desembarque e transporte de viajantes em embarcações de cruzeiros marítimos localizadas em águas jurisdicionais brasileiras, incluindo aquelas com viajantes provenientes de outros países, em virtude da pandemia provocada pelo novo coronavírus.
Na ocasião, ainda será analisada a proposta de abertura de processo regulatório da RDC 301/2019, que trata das Diretrizes Gerais de Boas Práticas de Fabricação de Medicamentos e da alteração da IN 35/2019, que dispõe sobre as Boas Práticas de Fabricação Complementares a Medicamentos Estéreis. Os referidos temas também serão objeto de propostas de RDC e IN.
Outro tópico em pauta é a proposta de RDC para rever a RDC 25/2001, que dispõe sobre a importação, a comercialização e a doação de dispositivos médicos usados e recondicionados. Os diretores também irão analisar a proposta de IN para definir a lista de substâncias classificadas como antimicrobianos de uso sob prescrição, isoladas ou em associação, de que trata a RDC 471/2021.
Por fim, a pauta traz proposta de alteração da Portaria 162/2021, para dispor sobre as diretrizes e os procedimentos para melhoria da qualidade regulatória na Agência. Também haverá o julgamento de recursos administrativos e de efeitos suspensivos.
Anvisa faz recomendações sobre doses de reforço de vacinas contra Covid-19
Apresentação das recomendações foi feita pela diretora-relatora Meiruze de Sousa Freitas, durante a 18ª Reunião Extraordinária Pública da Diretoria Colegiada (Dicol).
Nesta quarta-feira (24/11), a Diretoria Colegiada (Dicol) da Anvisa apresentou e aprovou por unanimidade uma série de recomendações sobre a aplicação de doses de reforço de vacinas contra a Covid-19 em grupos populacionais prioritários. A dose de reforço refere-se à aplicação de uma dose a mais na população, além do esquema de vacinação primário (uma ou duas doses, dependendo da vacina usada).
A apresentação das recomendações foi feita pela diretora-relatora Meiruze Sousa Freitas, durante a 18ª Reunião Extraordinária Pública da Dicol. Confira a íntegra do voto da diretora.
Foram apresentadas 16 recomendações direcionadas ao Ministério da Saúde, entre elas a necessidade da adoção de um programa adicional de farmacovigilância do uso de vacinas, especialmente quando vacinas forem empregadas de maneira divergente ao já aprovado em bula pela Agência.
A Agência recomenda também que haja uma ação de comunicação eficiente e objetiva para esclarecer os profissionais de saúde e a população sobre o uso de diferentes vacinas na aplicação de doses de reforço, entre outras orientações.
Além disso, a relatoria apresentou quatro recomendações específicas sobre cada esquema vacinal de reforço, considerando as características das vacinas aprovadas e disponíveis no país. Veja abaixo as recomendações, conforme consta no voto:
1. considerando a aprovação da Anvisa para a inclusão da dose de reforço na bula da vacina Comirnaty, reafirmamos que seja adotada a aplicação da vacina homóloga (mesma vacina) para o esquema da vacinação de reforço referente ao esquema primário da vacina Comirnaty, conforme aprovação da Anvisa;
2. considerando a decisão da Anvisa de aprovar a dose de reforço da vacina da Pfizer, a resposta imunogênica da vacina mRNA, a recomendação de outros países da vacina de mRNA como dose de reforço, independentemente da vacinação primária, e os estudos científicos sobre a efetividade da vacina, e até que novas evidências contraindiquem, quando for necessário usar uma vacina heteróloga, a vacina Comirnaty (Wyeth/Pfizer) é a recomendação preferencial como dose única de reforço, independentemente da vacina contra a Covid-19 primária usada;
3. considerando a responsabilidade e os compromissos dos desenvolvedores das vacinas, as ações da Anvisa já adotadas pela farmacovigilância para os esquemas vacinais primários, bem como a recente aprovação da FDA para a aplicação de uma dose de reforço ao esquema primário da vacina da Janssen, e até que a Anvisa decida os dois protocolos já submetidos à Agência para a inclusão da dose de reforço na bula da vacina da Janssen e da vacina da AstraZeneca/Fiocruz, recomenda-se, preferencialmente, as vacinas conforme o esquema homólogo proposto pelos desenvolvedores para os esquemas da vacinação de reforço referentes ao esquema primário das vacinas da AstraZeneca/Fiocruz e da Janssen;
4. considerando a recomendação desta Agência emitida em 18/08/2021, referente à vacina de vírus inativado avaliada pela Anvisa que teve a eficácia vacinal relativamente menor em comparação com as vacinas de mRNA, a resposta imunogênica da vacina mRNA, onde a tecnologia foi a mais relatada nas publicações científicas, bem como nas decisões das autoridades internacionais para o uso do esquema heterólogo e que, até o momento, o Instituto Butantan não protocolou e não tem a bula aprovada para a posologia de dose de reforço com a sua própria vacina, recomenda-se preferencialmente a vacina heteróloga de tecnologia mRNA aprovada pela Anvisa para o esquema da vacinação de reforço referente ao esquema primário da vacina CoronaVac.
A Anvisa informa que a análise sobre o tema foi realizada após o Ministério da Saúde anunciar a ampliação da recomendação da dose de reforço para toda a população adulta acima de 18 anos que tenha concluído a imunização contra a Covid-19. As recomendações foram feitas com base nos dados atualmente disponíveis, bem como nas análises concluídas pela Agência. A Anvisa segue avaliando os protocolos submetidos pelas desenvolvedoras de vacinas, que podem resultar em alteração das recomendações atualmente apresentadas.
Leia a seguir as 16 recomendações da Anvisa ao Ministério da Saúde. Os itens estão conforme constam no voto da relatora.
1. adoção de um programa adicional para o monitoramento e farmacovigilância do uso da vacinação em desacordo com a bula;
2. estabelecer monitoramento para os diferentes esquemas vacinais adotados no Brasil;
3. manutenção dos estudos conduzidos pela Fiocruz referentes ao monitoramento das vacinas, incluindo os diferentes esquemas vacinais atualmente adotados no país;
4. criação de mecanismos para a realização do monitoramento pós-distribuição e pós-uso das vacinas nos novos esquemas vacinais;
5. acompanhamento pelo Programa Nacional de Imunizações (PNI) das doses de reforço aplicadas das vacinas contra a Covid-19;
6. realização de monitoramento contínuo, considerando os riscos e os benefícios da estratégia adotada, devendo ter atenção especial para as reações adversas graves como: síndrome de trombocitopenia, síndrome de Guillain Barré e linfadenopatia, bem como o risco de miocardite e pericardite após o recebimento da vacina de mRNA;
7. monitoramento quanto às reações adversas raras e muito raras após um reforço, uma vez que essas ainda não são conhecidas;
8. adiamento, por precaução, da dose adicional de vacina de mRNA em indivíduos que tiveram miocardite ou pericardite após qualquer dose anterior da vacina de mRNA, até que mais informações estejam disponíveis. A mesma medida também deve ser adotada para todas as vacinas, no caso do vacinado ter apresentado evento adverso grave após qualquer dose anterior;
9. avaliação sobre se há contraindicação médica para a dose de reforço, considerando as características intrínsecas e as reações adversas de cada tipo de vacina;
10. considerar as atualizações dos estudos sobre a eficácia em longo prazo da dose de reforço, uma vez que ainda é desconhecido o tempo adicional de proteção que a dose extra conferirá, nos diferentes esquemas vacinais;
11. adoção de procedimentos para revisões contínuas quando estiverem disponíveis informações adicionais sobre a eficácia, a segurança e a imunogenicidade das doses de reforço de vacinas contra Covid-19;
12. prestação de orientações aos serviços de saúde e aos cidadãos sobre os novos esquemas vacinais adotados, bem como sobre como notificar queixas técnicas e eventos adversos a eles relacionados;
13. comunicação eficiente e objetiva para os profissionais de saúde e a população. Todos precisam ser informados sobre as diferentes doses de reforço das vacinas contra Covid-19, com comunicação clara quanto ao que é conhecido e desconhecido, bem como quais são os riscos e benefícios de uma dose adicional;
14. coordenação junto aos estados e munícipios para a harmonização de procedimentos e a captação de sinais de interesse para farmacovigilância e monitoramento do perfil das reações adversas;
15. reavaliar a manutenção da padronização generalizada para o intervalo de cinco meses entre a última dose do esquema primário e a dose de reforço;
16. avaliação dos benefícios e dos riscos da incorporação dos esquemas de dose de reforço propostos pelas desenvolvedoras das vacinas, até que a Anvisa decida os protocolos referentes à inclusão da dose de reforço nas bulas da vacina da Janssen Cilag e da vacina Vaxzeria (AstraZeneca/Fiocruz).

Webinar aborda capacitação de inspetores da área de sangue, tecidos e células
Na próxima segunda-feira (29/11), às 10h, a Anvisa irá realizar um seminário virtual para divulgar a capacitação de inspetores na área de sangue, tecidos e células. Participe!
A Anvisa informa que na próxima segunda-feira (29/11), a partir das 10h, irá realizar um seminário virtual para divulgar o programa de cursos de ensino à distância (EAD) da plataforma AVA-Visa (Ambiente Virtual de Aprendizagem em Vigilância Sanitária) para a capacitação de inspetores do Sistema Nacional de Vigilância Sanitária (SNVS) na área de sangue, tecidos e células.
Durante o evento, os participantes poderão esclarecer dúvidas sobre o programa. Para participar do webinar, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 29/11, às 10h – Webinar: Lançamento dos cursos EAD para capacitação de inspetores do Sistema Nacional de Vigilância Sanitária na área de sangue, tecidos, células e órgãos.
Webinar
O Webinar é um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizado ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento. Confira a página específica de webinares realizados pela Agência.
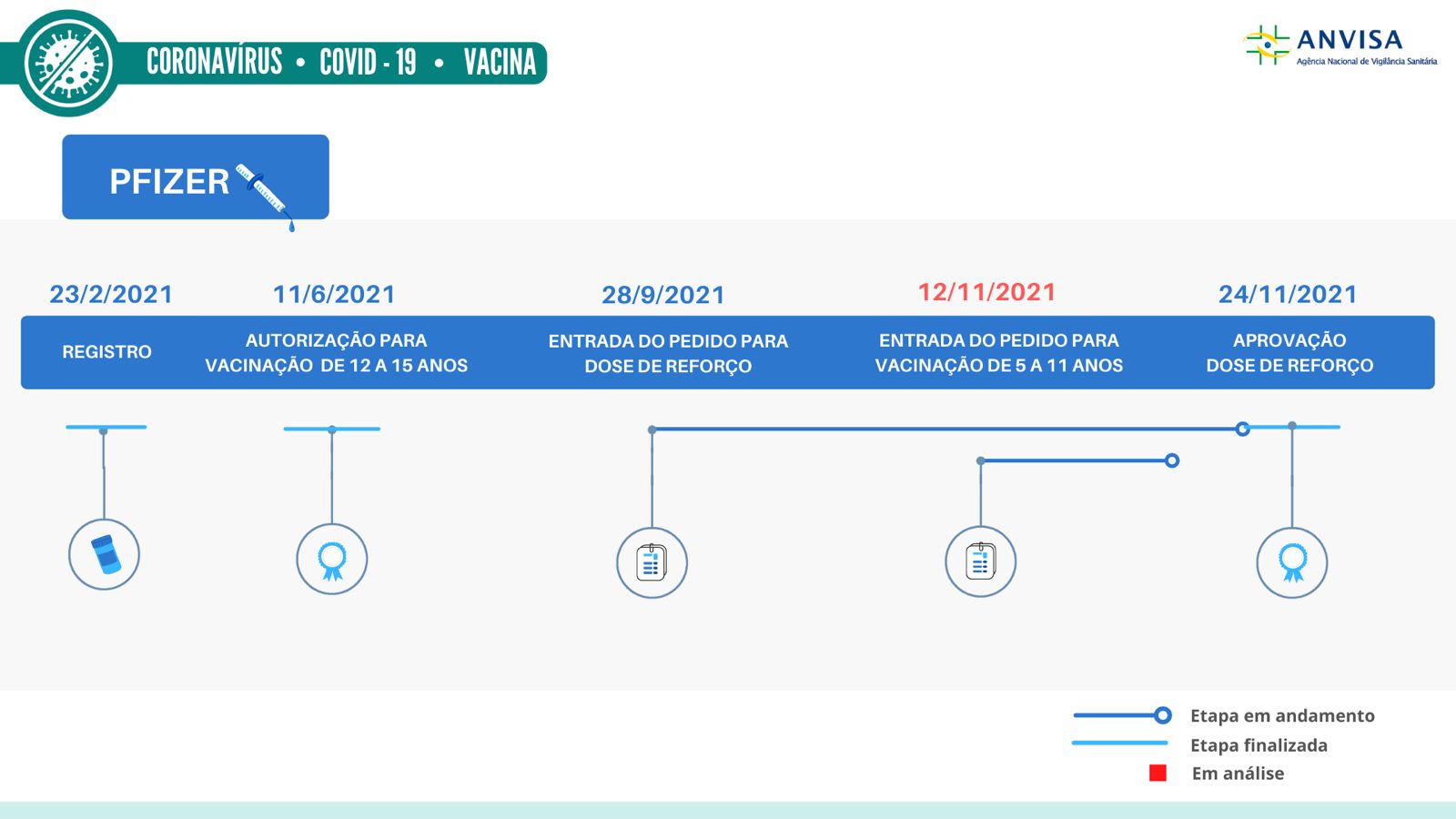
Anvisa autoriza inclusão de dose de reforço na bula da Pfizer
Com a aprovação, a bula da vacina Comirnaty trará a indicação de dose de reforço pelo menos seis meses após o recebimento da segunda dose.
A Anvisa aprovou a autorização da dose de reforço solicitada pela Pfizer para a sua vacina contra Covid-19, a Comirnaty. Isso significa que a Agência avaliou os dados e estudos apresentados pelo laboratório e concluiu que as evidências científicas demonstram segurança e eficácia para a aplicação da dose de reforço da Pfizer.
Com a aprovação da Anvisa, a bula da vacina Comirnaty trará a indicação de dose de reforço pelo menos seis meses após o recebimento da segunda dose, para pessoas com 18 anos de idade ou mais. A indicação de reforço aprovada pela Agência é de uso homólogo, ou seja, para pessoas que receberam a mesma vacina (Comirnaty) na primeira imunização.
Como a Comirnaty é uma vacina já registrada no país, a decisão final sobre a inclusão da dose de reforço na bula é da própria Gerência-Geral de Medicamentos da Agência.
Indicação aprovada e motivos
A indicação de bula é baseada nos estudos clínicos e resultados desenvolvidos pelo laboratório, que neste caso avaliou a administração do reforço em voluntários que foram imunizados inicialmente com o esquema de duas doses da Pfizer. Também foram avaliados dados de monitoramento do uso da vacina da Pfizer no Brasil.
Entre as justificativas avaliadas pela Anvisa estão dados de estudos científicos que indicam a diminuição dos anticorpos neutralizantes e algumas evidências de diminuição de eficácia da vacina contra a Covid-19. Outro dado considerado foi o surgimento de variantes do vírus Sars-CoV-2, incluindo a variante Delta.
Principais pontos da decisão
Foi aprovada tecnicamente a dose de reforço para pessoas imunizadas anteriormente com a vacina da Pfizer.
A dose de reforço será indicada em bula apenas para pessoas com 18 anos de idade ou mais.
A dose de reforço deve ser aplicada pelo menos seis meses após a segunda dose (vacinação completa).
O estudo analisado reuniu dados de 300 indivíduos incluídos no estudo clínico de fases 1/2/3 da vacina.
Não foram apresentados dados de reforço heterólogo, ou seja, para pessoas que se imunizaram com outras vacinas contra a Covid-19.
A vacina Comirnaty está registrada no Brasil desde 23 de fevereiro de 2021.
Reforço ou terceira dose?
A dose de reforço é uma aplicação adicional de uma vacina após a pessoa ter o esquema completo de imunização previsto na bula. No caso da vacina da Pfizer, a imunização completa acontece com duas doses, com um intervalo maior ou igual a 21 dias após a primeira. A dose de reforço tem o objetivo de manter ou mesmo melhorar a imunidade gerada pelo esquema primário de vacinação, evitando que após um longo período a resposta imune no organismo comece a diminuir.
Terceira dose é o termo que se aplicaria aos casos em que o esquema completo de imunização fosse alcançado somente com três doses. Ou seja, seria o caso de um imunizante em que são necessárias três doses da vacina para que o indivíduo possa estar imunizado.
Na prática, não existem vacinas contra Covid-19 no Brasil com esquema de três doses. As vacinas autorizadas pela Anvisa no país são de dose única, como no caso da vacina da Janssen, ou de duas doses, no caso das demais.
Termo de compromisso
Para a autorização da inclusão da dose de reforço em bula, a Pfizer ainda deve firmar um termo de compromisso para a apresentação de dados complementares identificados como lacunas durante a avaliação técnica.
Os principais pontos do termo de compromisso são:
- Dados clínicos adicionais sobre eficácia, imunogenicidade e segurança da dose de reforço.
- Plano de gerenciamento de risco com inclusão da dose de reforço.
- Dados de efetividade e de segurança de "vida real".
Outras análises em andamento
A Anvisa analisa, neste momento, os pedidos da AstraZeneca e da Janssen para inclusão de dose de reforço na bula de suas vacinas. No caso da CoronaVac, também em uso no Brasil, ainda não há pedido do laboratório para avaliação de doses de reforço.
Confira os detalhes dos outros processos em análise
O pedido da AstraZeneca trata do reforço homólogo, ou seja, aplicação da vacina da AstraZeneca como reforço para pessoas que foram imunizadas inicialmente com a mesma vacina. Esse pedido foi solicitado no último dia 17 de novembro.
Já o pedido da Janssen abrange tanto o reforço homólogo como heterólogo. No caso do uso heterólogo (vacina diferente do esquema inicial), a proposta da empresa pede a indicação apenas para pessoas que concluíram a vacinação primária com uma vacina de tecnologia mRNA. Atualmente, a única vacina de mRNA aprovada no Brasil é a vacina da Pfizer. Esse pedido da Janssen foi apresentado à Anvisa no último dia 19 de novembro.
No caso da CoronaVac, a Anvisa solicitou ao Instituto Butantan, em 27 de agosto, informações sobre o andamento dos estudos científicos ou regulatórios que possam subsidiar doses de reforço ou revacinação com a sua vacina. Até agora, não há solicitação do Butantan para esta análise. No momento, as lacunas sobre a imunogenicidade e o acompanhamento dos vacinados no estudo da CoronaVac limitam as conclusões sobre a duração da proteção desta vacina.
- Confira a nota sobre o pedido em análise da AstraZeneca.
- Confira a nota sobre o pedido em análise da Janssen.
Quem são os heróis da resistência microbiana? Entenda!
Esses profissionais, que você muitas vezes não vê, cuidam para garantir o tratamento adequado para as infecções.
Hoje é o encerramento da Semana Mundial de Conscientização sobre o Uso de Antimicrobianos, mas o combate à resistência microbiana aos antimicrobianos não para por aqui, muito pelo contrário. A expectativa é que esse trabalho se intensifique ano após ano, de modo a evitar a necessidade de cuidados mais intensivos, longas internações em hospitais e também o risco de invalidez e mortes de pacientes.
Para fechar a campanha, a Anvisa homenageia os chamados “Heróis da resistência”. Esses profissionais são imprescindíveis, principalmente nos serviços de saúde, para redução de riscos e promoção do bem-estar. Essas pessoas, que muitas vezes você não vê, têm um papel fundamental no que diz respeito ao controle e ao monitoramento do uso adequado e eficaz dos medicamentos antimicrobianos.
Em todo o país, temos milhares desses heróis. São enfermeiros, farmacêuticos, médicos, infectologistas, pesquisadores, professores, bioquímicos e tantos outros especialistas na área da saúde que se mobilizam também para promover a sensibilização e o reconhecimento do problema pela sociedade.
A Anvisa, e especialmente a área de Serviços de Saúde, parabeniza esses heróis e agradece a cada um deles. Impossível nomear todos e descrever a linda história de dedicação e luta em prol da promoção da saúde. Mas, em nome de todos, podemos contar a história da médica infectologista Sylvia Lemos Hinrichsen, que participou do seminário virtual realizado pela Agência para tratar do programa de gerenciamento do uso de antimicrobianos.
Há 15 anos Sylvia Hinrichsen dedica-se ao controle de infecções em vários hospitais públicos e privados de Recife. Atualmente, ela coordena projetos na área de biossegurança e controle de infecções em quatro hospitais, três deles no sertão de Pernambuco. Sua missão profissional – e de vida – é proporcionar mais segurança aos pacientes, prevenindo possíveis efeitos adversos. A médica e professora titular do Departamento de Medicina Tropical da Universidade Federal de Pernambuco (UFPE), a despeito de todas as dificuldades, sente imenso prazer no que faz: “Amo trabalhar com controle de infecção, apesar de ser difícil, pois exige mudança de comportamentos”.
Fique ligado
A resistência microbiana é caracterizada pela capacidade de microrganismos como bactérias, fungos e parasitas, entre outros, resistirem à ação de medicamentos antimicrobianos. Esta classe de fármacos inclui antibióticos, antivirais, antifúngicos e antiparasitários.
Segundo o Centro de Controle e Prevenção de Doenças (Centers for Disease Control and Prevention – CDC) dos Estados Unidos, mais de 2,8 milhões de infecções resistentes a antibióticos ocorrem nos EUA a cada ano e mais de 35 mil pessoas morrem como resultado disso. Na União Europeia, a resistência microbiana aos antimicrobianos é responsável por cerca de 33 mil mortes por ano e estima-se que custe 1,5 bilhão de euros anuais em gastos com saúde e em perda de produtividade.
O que eu posso fazer?
Não tome antimicrobianos por conta própria, ou seja, não pratique a automedicação. Para que esses medicamentos atinjam o efeito desejado, eles exigem uma administração adequada e indicação correta. Medicamentos antimicrobianos devem ser recomendados e receitados por um profissional de saúde.
Leia as matérias da Semana Mundial de Conscientização sobre o Uso de Antimicrobianos 2021:
- Anvisa promove webinar sobre gerenciamento do uso de antimicrobianos
- Serviços de saúde devem estar atentos à resistência microbiana
- Resistência microbiana preocupa autoridades de saúde
- Webinar da Anvisa irá atualizar serviços de saúde para 2022
- ICMRA incentiva engajamento na conscientização sobre antimicrobianos
- Campanha: saiba mais sobre resistência microbiana e como combatê-la!
- Confira dados mundiais sobre resistência microbiana
Fonte: Anvisa, em 24.11.2021.


