9°Simbravisa: servidores da Agência contribuem com trabalhos científicos
para repensar a vigilância sanitária
Encontro reúne profissionais, pesquisadores e estudantes em João Pessoa.
Cerca de 70 profissionais de diversas áreas da Anvisa participam do 9° Simpósio Brasileiro de Vigilância Sanitária (Simbravisa), que acontece até esta sexta-feira (24/11) em João Pessoa (PB) e reúne mais de 1100 participantes de todo o Brasil , entre profissionais de saúde, pesquisadores e estudantes.
Os servidores da Agência contribuem com trabalhos científicos e relatos de experiências, muitas delas vivenciadas durante o recente período pandêmico; além de participarem na condução de atividades da programação do simpósio, como a coordenação de mesas redondas e discussões temáticas.
Dentre os temas dos trabalhos apresentados estão, por exemplo: saúde dos trabalhadores do SUS; vigilância de eventos adversos; monitoramento de casos de Covid-19 em embarcações e aeronaves; participação social na construção de instrumentos regulatórios e medidas sanitárias no acolhimento a refugiados em áreas de aeroportos.
Painéis
Profissionais da Anvisa também participam da apresentação de diversos painéis de discussão durante a programação do 9°Simbravisa. No painel “A nova rotulagem de alimentos contribui na proteção da saúde?", o servidor Tiago Rauber, Coordenador de Padrões e Regulação de Alimentos da Anvisa explicou como se deu o processo de construção regulatória da atual norma de rotulagem nutricional, seu alcance e a importância da participação social durante o processo.
Meiruze Freitas, servidora de carreira e atual diretora da Agência, foi uma das apresentadoras do painel “Vacinas contra Covid-19 e o Processo Regulatório”, na tarde desta quinta-feira (23/11). “ A gente só conseguiu chegar até aqui porque as informações fluíam de forma rápida entre os órgãos reguladores internacionais e os pesquisadores. Exemplo disso foi termos estabelecido a submissão contínua (avaliação dos dados técnicos à medida em que eles vão sendo gerados) desde a etapa de pesquisa clínica das vacinas ” relembrou Meiruze Freitas ao falar sobre o processo de aprovação das primeiras vacinas contra a Covid-19.
“Um dos grandes desafios enfrentados durante a pandemia foi a guerra de contra-informações, baseada em fake news”, pontuou Freitas.
Outros painéis apresentados por servidores da Anvisa são: “Vigilancia de eventos adversos e proteção da saúde”; “Novas tecnologias e desafios para os laboratórios de saúde pública” e “Reconhecimento da Anvisa como Autoridade de Referência para a OMS”
Rodas de conversa
“Lei de Liberdade econômica e a atuação da vigilância sanitária” é o tema de uma das rodas de conversa conduzida por servidores da Agência. Outra discussão de destaque nessa modalidade é a que trata da “ Harmonização dos procedimentos de serviços de saúde”.
Oficinas
Durante a programação pré-congresso a Anvisa também conduziu algumas oficinas, com destaque para a de “Diretrizes para revisão dos códigos sanitários” voltada aos estados e municípios.
O Simbravisa é realizado pela Associação Brasileira de Saúde Coletiva (Abrasco) em parceria com a Secretaria Estadual de Saúde da Paraíba. Mais informações em https://www.simbravisa.org.br/index.php#topo

Servidores da Anvisa no Simbravisa

A nova rotulagem de alimentos contribui na proteção da saúde?

Apresentação da diretora Meiruze
Secretaria Executiva da CMED informa instabilidade no envio de pareceres pelo sistema Visapar
Agência está adotando as providências necessárias para envio dos pareceres às empresas
A Secretaria Executiva da Câmara de Regulação do Mercado de Medicamentos (SCMED) informa a ocorrência de oscilação no envio de pareceres referentes aos Documentos Informativos de Preços (DIP), por meio do sistema Visapar às empresas. Foi detectado que a falha teve início durante o dia 13/11/23.
A fim de evitar transtornos para as empresas, como decorrência da instabilidade no envio de pareceres pelo sistema, a SCMED reencaminhará todos os pareceres homologados no período, assim que o erro no sistema for corrigido.
A Anvisa está adotando as medidas necessárias visando ao pronto reestabelecimento do sistema, apresentando desculpas pelos eventuais transtornos.
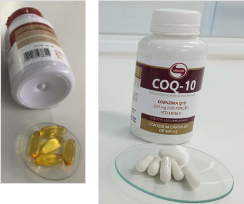
Anvisa determina apreensão e proibição de versões falsificadas de suplementos alimentares
Os produtos são COQ-10 200mg, KRILL VIT, ÔMEGA 3 - EPA DHA e OMEGAFOR VISION, da marca Vitafor.
A Anvisa publicou, no Diário Oficial da União (D.O.U.) desta quinta-feira (23/11), a determinação de apreensão e a proibição da fabricação, distribuição, comercialização e propaganda dos suplementos alimentares falsificados COQ-10 200mg, KRILL VIT, ÔMEGA 3 - EPA DHA e OMEGAFOR VISION, marca Vitafor. Os produtos são divulgados e comercializados em diversas plataformas eletrônicas de vendas. A medida foi divulgada por meio da Resolução-RE 4.445, de 21 de novembro de 2023.
A empresa distribuidora dos produtos, Vida Forte Nutrientes Indústria e Comércio de Produtos Naturais Ltda. - CNPJ: 07.455.576/0001-92, comunicou à Anvisa a falsificação de seus produtos e disponibilizou imagens com as diferenças entre os produtos originais e os falsificados.
Para saber diferenciá-los, é necessário ficar atento às características das embalagens e dos rótulos, pois, em algumas situações, as diferenças podem ser sutis. Há diferenças também nas características das cápsulas.
Veja como diferenciar o produto original do falsificado
Coenzima Q10 original é apresentado em cápsulas gelatinosas moles na cor laranja, enquanto há versões falsificadas em cápsulas duras e cápsulas gelatinosas moles em outra cor.
O frasco do produto falsificado é mais brilhoso que o do produto original. O rótulo do produto falsificado possui letras em tamanho maior.
As informações sobre lote e validade do produto original estão descritas no fundo do frasco, enquanto as do produto falsificado estão no rótulo lateral.
|
Original |
Falsificado |
|
original |
falsificado |
|
frasco produto original |
falsificado |
KRILL VIT original é apresentado em cápsulas gelatinosas pretas, enquanto o falsificado é apresentado em cápsulas duras. O frasco do produto falsificado é mais brilhoso que o do produto original. O rótulo do produto falsificado possui tonalidade de azul mais clara.
|
Original |
Falsificado |
|
original |
falsificado |
ÔMEGA 3 EPA DHA falsificado é apresentado em cápsulas gelatinosas transparentes, com pouca diferença do original. A tampa do rótulo original é azul- escura, enquanto nas versões do produto falsificado a tampa é branca. As informações de rotulagem dos painéis secundários do rótulo do produto original são coloridas e as do produto falsificado são em preto e branco.
Original
|
original |
original |
omega original |
Falsificado
|
falsificado |
falsificado |
falsificado |
|
falsificados |
falsificado |
|
Se você adquiriu um produto e está em dúvida se é falsificado, entre em contato com a fabricante do produto original, pelo e-mail sac@vitafor.com.br.
A Anvisa solicita aos serviços de saúde que, caso identifiquem unidades com essas características de falsificação, não utilizem os produtos e comuniquem o fato à Agência, pelos Canais de Atendimento https://www.gov.br/anvisa/pt-br e pelo https://falabr.cgu.gov.br/, ou às Vigilâncias Sanitárias (Visas) locais, por meio dos canais disponíveis para consulta no portal da Anvisa: https://www.gov.br/anvisa/pt-br/assuntos/snvs/contatos-vigilancias-sanitarias
A Agência continua investigando o caso e adotando as medidas necessárias.
Aprovada consulta pública sobre convergência regulatória na área de alimentos
Norma ficará disponível para contribuições por 90 dias.
A Diretoria Colegiada da Anvisa aprovou, na Reunião Ordinária Pública desta quarta-feira (22/11), minuta de consulta pública sobre as condições para procedimento otimizado de análise das petições de avaliação, na área de alimentos, pela admissão de documentação instrutória emitida por Autoridade Reguladora Estrangeira Equivalente (AREE).
A proposta de norma ficará em consulta pública pelo período de 90 dias e será publicada no portal da Agência para receber considerações e sugestões do setor de alimentos, da sociedade civil organizada e dos demais interessados.
A proposta normativa busca estender as condições para procedimento otimizado de análise ao conjunto de petições de avaliação na área de alimentos, bem como complementar os critérios gerais estabelecidos pela Anvisa na RDC 741/2022, incluindo:
a) definição da lista de AREEs admitidas no âmbito das petições de avaliação na área de alimentos;
b) estabelecimento das condições e dos procedimentos para a admissão de novas AREEs;
c) previsão de requisitos documentais e de qualidade para admissão das decisões emitidas pela AREE, quer seja como referência única ou complementar;
d) estruturação de vias de instrução documental simplificada, em caso de aproveitamento das decisões da AREE como referência única; e
e) imposição de deveres ao interessado na adoção do procedimento otimizado, no caso de as AREEs reverem as decisões proferidas.
Práticas colaborativas e de convergência regulatória
A estratégia do reliance (compartilhamento regulatório) faz com que a Agência possa adotar práticas internacionais consideradas de referência, aproxima a Anvisa ainda mais das agências reguladoras estrangeiras e aumenta a confiança entre essas autoridades. Além disso, a convergência regulatória cria processos administrativos mais dinâmicos e favorece cada vez mais a chegada de novas tecnologias e a ampliação do acesso da população aos produtos regulados pela Agência, já que, juntamente com a sociedade civil organizada e o setor regulado, os cidadãos poderão participar da consulta pública.
Na Anvisa, as práticas colaborativas sempre fizeram parte da regulação de alimentos, estando presentes em vários marcos normativos editados pela Agência, inclusive por meio do reconhecimento de decisões de AREEs, como o Codex Alimentarius, o Comitê Conjunto de Especialistas sobre Aditivos Alimentares da Organização das Nações Unidas para a Alimentação e Agricultura (Joint FAO/WHO Expert Committee on Food Additives – JECFA), o Código de Produtos Químicos Alimentares (Food Chemicals Codex – FCC), o Compêndio de Suplementos Alimentares da Farmacopeia Americana (United States Pharmacopeia Dietary Supplements Compendium – USP-DSC) ou de referências de autoridades estrangeiras.
Confira o voto da diretora relatora, Meiruze Freitas.
Fonte: Anvisa, em 23.11.2023.