Anvisa aprova vacinas bivalentes para dose de reforço contra Covid-19
Vacinas da Pfizer protegem contra novas variantes do vírus.
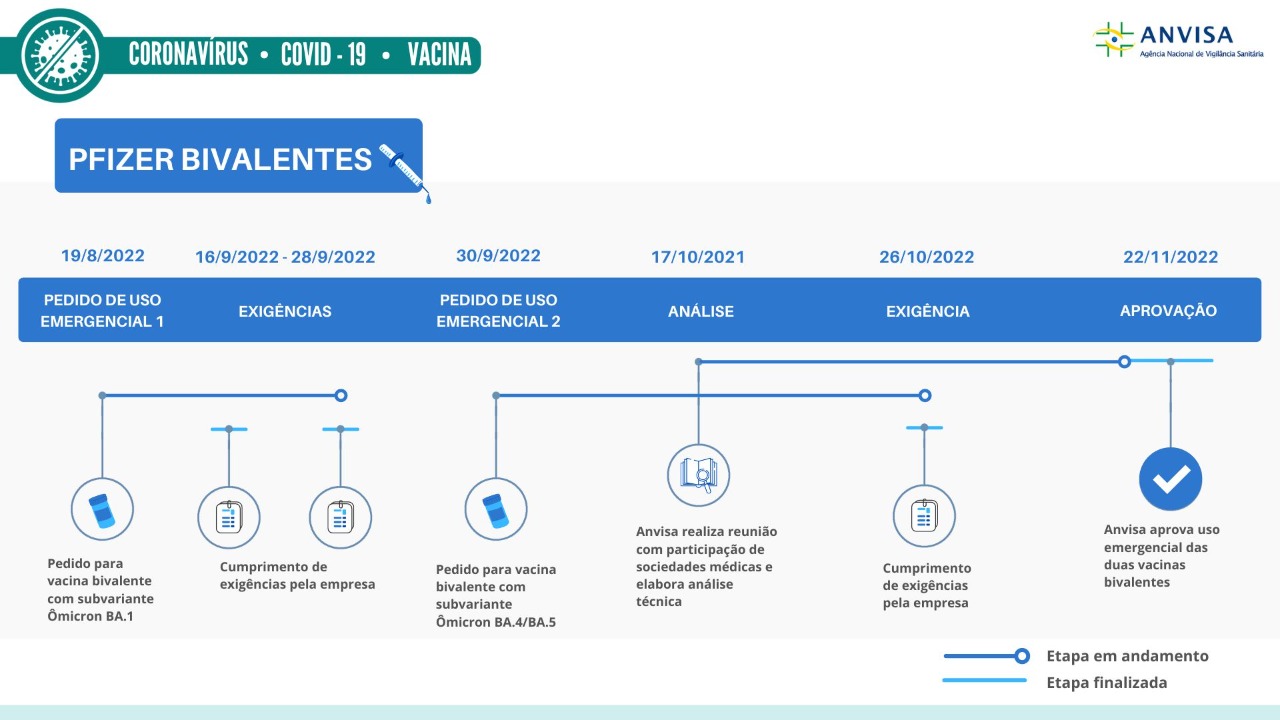
A Diretoria Colegiada da Anvisa aprovou, nesta terça-feira (22/11), o uso temporário e emergencial de duas vacinas bivalentes contra Covid-19 da empresa Pfizer (Comirnaty). As vacinas aprovadas são para uso como dose de reforço na população a partir de 12 anos.
As vacinas bivalentes oferecem proteção contra mais de uma cepa de um vírus. As vacinas aprovadas protegem contra:
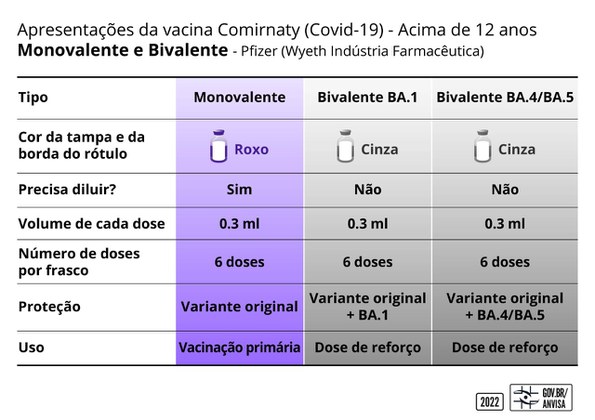
• Bivalente BA1 – protege contra a variante original e também contra a variante Ômicron BA1.
• Bivalente BA4/BA5 – protege contra a variante original e também contra a variante Ômicron BA4/BA5.
Segundo a diretora relatora, Meiruze Freitas, o objetivo do reforço com a vacina bivalente é expandir a resposta imune específica à variante Ômicron e melhorar a proteção da população. “Entretanto, as pessoas, principalmente os grupos de maior risco, não devem atrasar sua vacinação de dose de reforço já planejada para esperar o acesso à vacina bivalente, pois todas as vacinas de reforço aprovadas ajudam a melhorar a proteção contra casos graves e morte por Covid-19”, afirmou a diretora da Anvisa.
Veja as apresentações das áreas técnicas:
- Apresentação da área de Biológicos (GGBIO)
- Apresentação da área de Inspeção e Fiscalização (GGFIS)
- Apresentação da área de Farmacovigilância (GFARM)
Saiba mais
Características das vacinas aprovadas
- Identificadas por tampa na cor cinza. O rótulo trará a seguinte identificação: Comirnaty® Bivalente BA.1 ou Comirnaty® Bivalente BA.4/BA.5.
- Cada frasco possui seis doses e a vacina não deve ser diluída.
- Indicadas para a população a partir de 12 anos de idade.
- Indicadas como reforço. Devem ser aplicadas a partir de três meses após a série primária de vacina ou reforço anterior.
- Validade de 12 meses, quando estocadas de -80°C a -60°C ou de -90°C a -60°C.
- Podem ser armazenadas em geladeira, entre 2°C e 8°C, por um único período de até dez semanas, não excedendo a data de validade original.
Cenário internacional
• A vacina Comirnaty Bivalente BA1 está aprovada em 35 países.
• A vacina Comirnaty Bivalente BA4/BA5 está aprovada em 33 países, tais como Canadá, Japão, Reino Unido, EUA, Austrália e Singapura, entre outros, além da União Europeia.
Especialistas externos
Para a análise das duas vacinas bivalentes, a Anvisa também contou com um grupo de especialistas externos da Sociedade Brasileira de Pediatria (SBP), da Sociedade Brasileira de Infectologia (SBI), da Sociedade Brasileira de Imunização (SBIm) e da Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), os quais emitiram parecer consultivo para auxiliar o trabalho de análise da Agência.
Vacinas monovalentes
Essas vacinas ainda mantêm a efetividade contra a doença na forma grave e óbitos, desde que as doses sejam aplicadas conforme a recomendação do Ministério da Saúde. Os estudos indicam que as doses de reforço das vacinas monovalentes restauraram uma proteção contra desfechos graves associados à Ômicron. A versão original da vacina monovalente da Pfizer está registrada no Brasil deste 23/2/2021.
Há outros pedidos de autorização para vacinas bivalentes?
Não. Até o momento a Anvisa não recebeu outros pedidos de vacinas contra a Covid-19 que incluam cepas de novas variantes.
Linha do tempo
Acompanhe a reunião da Dicol desta quarta-feira
Normas para regularização de cosméticos e atualização da Portaria 344/1998 estão entre os itens da pauta.
A partir das 10h desta quarta-feira (23/11), a Anvisa realiza a 22ª Reunião Ordinária Pública da Diretoria Colegiada de 2022. O encontro dos diretores será transmitido ao vivo pelo canal da Agência no YouTube.
Na pauta, está uma proposta para alterar a norma que trata sobre procedimentos e requisitos para regularização de cosméticos para alisar ou ondular cabelos. Também está prevista para votação dos diretores uma atualização da lista do Anexo I (Lista de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial) da Portaria SVS/MS 344/1998.
Veja aqui a pauta completa e abaixo um resumo de outros temas previstos para a reunião:
- Alteração da norma para regularização de produtos de higiene pessoal, cosméticos e perfumes.
- Proposta para rever a norma de Autorização de Funcionamento de Empresa (AFE) e de Autorização Especial (AE) de farmácias e drogarias.
- Abertura de processo para rever as diretrizes e os procedimentos para a abordagem dos eventos adversos do ciclo do sangue.
- Norma que estabelece procedimento especial para anuência de ensaios clínicos, certificação de boas práticas de fabricação e registro de novos medicamentos para tratamento, diagnóstico ou prevenção de doenças raras, com o objetivo de suspender a obrigatoriedade de realização de reunião de pré-submissão.
- Avaliação de Resultado Regulatório da norma sobre monitoramento econômico de dispositivos médicos.
- Proposta de Orientação de Serviço sobre o fluxo regulatório e os procedimentos para os assuntos de atualização periódica.
- Proposta de abertura de processo para alterar a regulamentação de materiais metálicos em contato com alimentos.
22ª Reunião Ordinária Pública da Diretoria Colegiada de 2022
Acompanhe a reunião pelo link abaixo:
Anvisa mantém atendimento presencial nos dias dos jogos do Brasil na Copa do Mundo
Protocolo e atendimento na sede da Agência em Brasília funcionarão em horário normal.
A Anvisa informa que, conforme a Portaria ME 9.763, de 9 de novembro de 2022, o atendimento presencial na sede da Agência, em Brasília (DF), será em horário normal nas datas dos jogos do Brasil na Copa do Mundo de Futebol.
O protocolo presencial de documentos funciona das 8h às 18h e o atendimento presencial das 7h às 19h.
A Central de Atendimento da Anvisa funcionará normalmente, das 7h30 às 19h30, pelo telefone 0800 642 9782. Além disso, a qualquer momento, o usuário pode registrar o seu pedido de informação por meio do formulário eletrônico Fale Conosco ou pela plataforma Fala.BR.
Vídeo sobre chegada ao Brasil de máscaras contaminadas com Covid-19 é falso
Anvisa esclarece sobre regras para entrada de produtos importados no país.
A Anvisa informa que é falso um vídeo que circula nas redes sociais, em que um homem alega que estariam chegando no Porto de Santos navios com contêineres carregados com máscaras contaminadas com Covid-19.
O falso vídeo circula desde 2020 e o autor já teria se retratado posteriormente, admitindo a falsa informação.
Além disso, a Agência esclarece que é proibida a importação ou a doação de material infectante, devendo a carga ser devolvida para o país de origem ou destruída após o tratamento indicado para material infectocontagioso. A empresa responsável pela importação é autuada por descumprimento do regulamento relacionado à importação desses produtos.
Sobre a possibilidade de o material infectante vir da China, a Anvisa informa que um estudo publicado na conceituada publicação científica New England Journal of Medicine constatou que o vírus pode sobreviver por até 72 horas em plásticos e aço inoxidável (inox), 24 horas em papelão e quatro horas em cobre. A quantidade de vírus existente nas superfícies vai diminuindo com o passar das horas, reduzindo o risco de contaminação. O tempo de viagem entre o Brasil e a China por via marítima é em média de 45 dias.
Todas as máscaras que entram no Brasil devem ter autorização da Agência para sua importação. A norma da Anvisa que dispõe sobre a importação de produtos sujeitos à vigilância sanitária é a RDC 81/2008.
Revisão do Código Sanitário: Anvisa convida gestores para colaborar
Agência também irá selecionar Vigilâncias Sanitárias para assessorar na implementação do código.
A Anvisa está desenvolvendo ações para a implantação do modelo para revisão dos códigos e regulamentos sanitários para o Sistema Nacional de Vigilância Sanitária (SNVS). Como parte desse programa, a Agência convida gestores das Vigilâncias para participar da revisão do Manual para Elaboração do Código Sanitário para o SNVS. Os gestores interessados devem levantar dados que possam apoiar a harmonização de conceitos e diretrizes.
Nesta etapa, a Agência também irá selecionar dez órgãos de vigilância sanitária que tenham interesse em receber assessoria técnica para a implementação do projeto. As inscrições estão abertas até o dia 10 de dezembro. Veja como participar:
- Para colaborar com a revisão do Manual:
- Preencher o formulário eletrônico de levantamento das informações do arcabouço técnico jurídico de atuação da vigilância sanitária, no âmbito do seu território, até o dia 10/12/2022.
- Para candidatar-se a participar da etapa de implantação das diretrizes do Código Sanitário, por meio de assessoramento de consultoria especializada:
- Manifestar interesse no processo de seleção, pelo formulário de interesse, e enviar e-mail até o dia 10/12/2022.
- Encaminhar manifestação de interesse para os e-mails csnvs@anvisa.gov.br e alex.matta@haoc.com.br, contendo, no campo do Assunto, “[CÓDIGO SANITÁRIO] [ESTADO/MUNICÍPIO] Resposta Carta Convite – Implantação do Código Sanitário”.
Saiba mais
Entre 2020 e 2022, estudos realizados pela Anvisa demonstraram que as normas estaduais e do Distrito Federal estão amparadas em regras jurídicas generalistas, que não mais atendem aos anseios da sociedade contemporânea nem à realidade dos determinantes e condicionantes de saúde de seu território. Esses estudos evidenciam que há uma variedade na aplicação dos temas e nas diretrizes estabelecidas nos regulamentos do Sistema Único de Saúde (SUS). Assim, é imprescindível que os estados, o Distrito Federal e os municípios, por meio dos seus órgãos de vigilância sanitária, revisem as diretrizes das suas normas, considerando as especificidades de cada território, por serem únicas e individuais.
Como fruto desse trabalho, a Agência elaborou e divulgou o Manual para Elaboração do Código Sanitário para o Sistema Nacional de Vigilância Sanitária - SNVS. O documento, que será atualizado pela Anvisa, tem como objetivo oferecer aos gestores da saúde, aos legisladores e à própria sociedade subsídios relacionados ao aprimoramento, à inovação e à modernização da estrutura técnica e jurídica dos órgãos de saúde e vigilância sanitária, com a adoção de requisitos harmonizados.
Participe da consulta dirigida sobre o sistema de recursos da Anvisa
Prazo de contribuição vai até o dia 16/12.
Está aberta a consulta dirigida para identificar os principais problemas que afetam a efetividade do sistema de recursos da Anvisa. A etapa faz parte do Projeto 1.16 - Procedimentos relativos à análise e deliberação dos recursos administrativos submetidos à Gerência-Geral de Recursos (GGREC) da Agência.
O objetivo da consulta, que está aberta até 16/12, é coletar subsídios para apoiar a análise de impacto regulatório (AIR) sobre o tema. Cidadãos, empresas, organizações da sociedade civil e qualquer interessado no assunto poderão participar, por meio deste formulário eletrônico.
Fonte: Anvisa, em 22.11.2022.


