Webinar orienta sobre dossiê técnico de equipamentos médicos
Atividade será realizada no dia 26 de junho, às 10h. Participe!
Na próxima segunda-feira (26/6), a Anvisa irá realizar uma videoconferência (webinar) para orientar o setor regulado sobre como atender e preencher os requisitos constantes na Estrutura de Dossiê Técnico. O documento, previsto no Anexo II da Resolução da Diretoria Colegiada (RDC) 751/2022, é necessário para fins de notificação e registro de equipamentos médicos junto à Agência.
Para participar do evento, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 26/6, às 10h – Webinar sobre a Estrutura de Dossiê Técnico de Equipamentos Médicos.
Webinar
É um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizados ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento.
Confira a página específica de webinares realizados pela Agência.
Anvisa publica novo manual de importação de dispositivos médicos
Documento tem como objetivo orientar importadores sobre as regras vigentes.
Está disponível no portal da Anvisa o novo Manual de Importação de Dispositivos Médicos. O documento tem o objetivo de orientar os importadores sobre as regras para submissão e os procedimentos de análise de processos de importação.
Os assuntos estão organizados em tópicos, que auxiliam a consulta sobre regularização de empresas e produtos, instrução processual e procedimentos de análise e de fiscalização. Também são indicadas as legislações e situações específicas aplicáveis a cada tópico.
Esta publicação não pretende substituir as orientações sobre peticionamento de processo de importação já publicadas pela Agência ou o manual disponível no Portal Siscomex. A ideia é complementar essas informações em aspectos específicos da anuência de importação de dispositivos médicos no contexto da Anvisa.
O novo manual será apresentado ao setor regulado na próxima segunda-feira (26/6), às 15h, por meio de um seminário virtual (webinar). Participe!
Dia 26/6, às 15h: Webinar: novo Manual de Importação de Dispositivos Médicos sob anuência da Anvisa
Anvisa alerta para casos de falsificação de medicamentos
Unidades de Botox, Dysport e Durateston foram falsificadas. Em caso de suspeita, os produtos não devem ser utilizados.
AAnvisa determinou, nesta quarta-feira (21/6), a apreensão e a proibição da comercialização, da distribuição e do uso de unidades falsificadas dos medicamentos Botox®️ (Lote: C3709C3) e Durateston® (Lote: 701012LR). A medida foi publicada por meio da Resolução RE 2.198/2023.
Já nesta quinta-feira (22/6), por meio da Resolução-RE 2.208/2023, também foram determinadas a apreensão e a proibição da comercialização, da distribuição e do uso de unidades falsificadas do lote W07209 do produto Dysport®️.
Os produtos podem ser diferenciados pelas datas de fabricação e validade, que são diferentes dos produtos originais. Veja um resumo das diferenças na tabela e saiba mais detalhes abaixo.
|
Produto |
Número do lote |
Datas do produto original |
Datas do produto falsificado |
|
Botox®️ |
C3709C3 |
Fabricação: 09/2014 Validade: 08/2017 |
Fabricação: 05/2022 Validade: 05/2025 |
|
Dysport®️ |
W07209 |
Fabricação: 01/2022 Validade: 12/2023 |
Fabricação: 01/2023 Validade: 12/2024 |
|
Durateston® |
701012LR |
Fabricação: 01/2021 Validade: 01/2023 |
Fabricação: 06/2022 Validade: 06/2024 |
Falsificação do Botox – lote C3709C3
As medidas foram tomadas após operação policial que encontrou embalagens do Botox®️ falsificadas.
A data de fabricação do lote original (C3709C3) é 09/2014 e a data de validade 08/2017. O produto falsificado traz o mesmo número de lote, mas a sua data de fabricação consta como 05/2022 e a de validade como 05/2025, conforme imagem abaixo.
Além disso, o lote original (C3709C3) não foi destinado ao mercado brasileiro, tratando-se, portanto, de falsificação. O medicamento Botox®️ está devidamente registrado em nome da empresa Allergan Produtos Farmacêuticos.
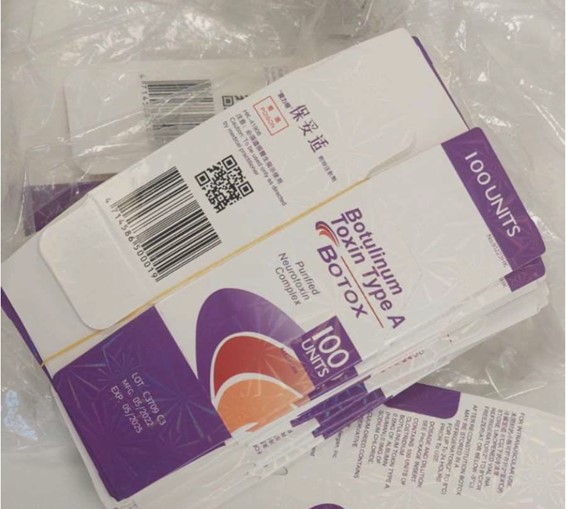
Embalagem do produto falsificado.
Falsificação do Dysport 300U (toxina botulínica A) – lote W07209
As medidas foram tomadas após a comunicação da empresa detentora do registro do medicamento, a Beaufour Ipsen Farmacêutica, à Anvisa.
A empresa esclarece que o lote W07209 do produto Dysport®️ 300U original foi importado em abril de 2022, com data de fabricação em 01/2022 e prazo de validade até 12/2023. Já o produto falsificado apresenta como data de fabricação 01/2023 e como data de validade 12/2024.
A empresa também descreveu diversas diferenças existentes entre o produto original e o falsificado. Foram verificadas discrepâncias no tipo de frasco, na qualidade de impressão do rótulo e no volume de produto no frasco, conforme fotos abaixo.
É importante esclarecer que o produto Dysport®️ 300 U, lote W07209, fabricado em janeiro de 2022 e com prazo de validade em dezembro de 2023, é verdadeiro e não há qualquer problema relacionado à qualidade, à eficácia e à segurança do produto, que pode estar disponível no mercado.
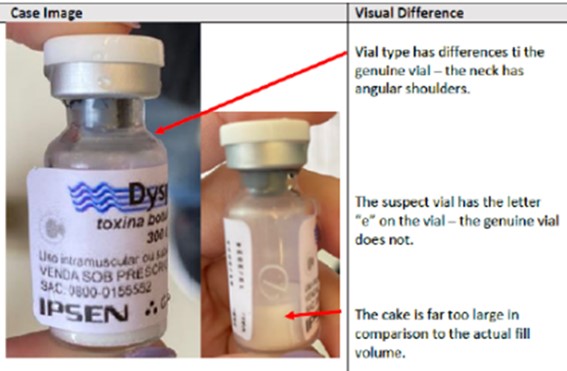
Produto falsificado: diferenças no frasco
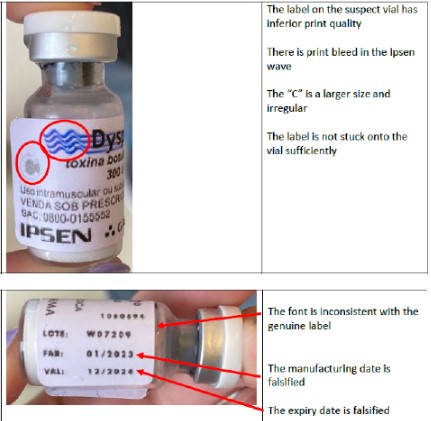
Produto falsificado: diferenças no rótulo
Falsificação do Durateston® – lote 701012LR
As medidas foram tomadas após a Anvisa ser informada pela empresa Aspen Pharma Indústria Farmacêutica Ltda. sobre a circulação, no mercado brasileiro, de unidades falsificadas do medicamento.
O número 701012LR corresponde a um número de lote original de Durateston®, fabricado em 01/2021 e válido até 01/2023. No entanto, as unidades falsificadas possuem data de fabricação e de validade divergentes (fabricação em 06/2022 e validade até 06/2024), conforme foto abaixo.

Embalagem do medicamento falsificado
Orientações gerais à população e aos profissionais de saúde
A Anvisa orienta que a população e os profissionais de saúde somente adquiram medicamentos em estabelecimentos devidamente regularizados, sempre na embalagem completa (dentro da caixa) e mediante emissão da nota fiscal.
Em caso de identificação de unidades dos medicamentos com suspeita de falsificação, a população ou os profissionais de saúde não devem utilizar o produto e devem entrar em contato com as empresas detentoras do registro desses produtos, para verificar sua autenticidade.
Além disso, o fato deve ser comunicado imediatamente à Anvisa, preferencialmente por meio do sistema Notivisa (no caso de profissional de saúde) ou por meio do sistema da Ouvidoria, utilizando a plataforma FalaBR (no caso de pacientes).
Fonte: Anvisa, em 22.06.2023.


