Anvisa amplia para quatro anos prazo de validade do Certificado de Boas Práticas de Fabricação
Medida vale para empresas participantes do programa MDSAP.
A validade do Certificado de Boas Práticas de Fabricação (CBPF) de fabricantes de dispositivos médicos concedido por meio do MDSAP (Medical Device Single Audit Program – Programa de Auditoria Única de Dispositivos Médicos) foi ampliada de dois para quatro anos, por meio da publicação da RDC 850, de 20 de março de 2024.
A proposta foi aprovada por unanimidade na Reunião da Diretoria Colegiada (ROP 03/2024) realizada no último dia 19 de março.
O diretor Rômison Rodrigues Mota ressaltou, em seu voto, que a alteração cria um ambiente favorável à adesão ao MDSAP, ao diminuir o custo regulatório para as empresas, ao mesmo tempo em que amplia o monitoramento e traz eficiência e agilidade ao processo de trabalho da Agência.
Já o diretor-presidente, Antonio Barra Torres, destacou que as empresas participantes do programa passarão a receber auditorias anuais para monitoramento do risco e verificação da manutenção do cumprimento das boas práticas de fabricação, contribuindo para o controle do risco sanitário dos produtos.
A ampliação da validade do certificado para quatro anos é condicionada à permanência do fabricante no MDSAP durante todo o período de vigência do certificado.
Sobre o MDSAP
O objetivo do programa é permitir que fabricantes de dispositivos médicos contratem um organismo auditor para realizar uma auditoria única, que contemple os requisitos relevantes das autoridades regulatórias que são integrantes oficiais do MDSAP (Austrália, Brasil, Canadá, Japão e Estados Unidos).
Os resultados das auditorias (relatórios e certificados) podem ser utilizados para fins de regularização das empresas e produtos junto aos países participantes do programa.
O crescimento do programa nos últimos anos tem ampliado o número de parceiros internacionais participantes.
Membros oficiais:
- Anvisa (Brasil);
- Health Canada (Canadá);
- TGA (Austrália);
- FDA (Estados Unidos); e
- PMDA (Japão).
Observadores oficiais:
- Organização Mundial da Saúde (OMS);
- Comunidade Europeia (EU); e
- MHRA (Reino Unido).
Membros afiliados:
- ANMAT (Argentina);
- MTIIR (Israel);
- MFDS (Coreia do Sul);
- HSA (Cingapura);
- TFDA (Taiwan);
- COFEPRIS (México); e
- Kenya's Pharmacy and Poisons Board (Quênia).
Até o momento, a Anvisa vem se beneficiando do programa, considerando que a certificação de boas práticas emitida pela Agência é realizada por meio da análise de relatórios e certificados emitidos pelos organismos auditores, sem a necessidade de realização de inspeção própria. A medida contribui para a emissão de CBPF com agilidade e economia de recursos humanos e financeiros.
Como participar do MDSAP
Os fabricantes de dispositivos médicos interessados devem entrar em contato diretamente com os organismos auditores reconhecidos para participação no programa. O modelo único de auditoria possibilita a utilização dos certificados e relatórios de auditoria por autoridades reguladoras de diferentes países, contribuindo para a convergência regulatória, a economia de recursos e a rapidez nas aprovações para comercialização dos dispositivos médicos nos respectivos países.
Confira a lista de organismos auditores do MDSAP.
Na análise dos pedidos de certificação, a Anvisa verifica se o fabricante a ser certificado foi auditado no âmbito do MDSAP. Para esses casos, a Agência utiliza relatórios ou certificados MDSAP, emitidos por organismos auditores reconhecidos, como subsídio para a análise do processo de certificação, incluindo aqueles previamente protocolados.
Mais informações sobre o programa estão disponíveis no portal da Anvisa ou no site oficial do MDSAP.
Esclarecimentos sobre a transparência das filas de análise na Anvisa
Aumento no volume de processos priorizados tem impactado as filas.
MEDICAMENTOS
Esclarecimentos sobre a transparência das filas de análise na Anvisa
Aumento no volume de processos priorizados tem impactado as filas.
Recentemente, a área de Medicamentos da Anvisa recebeu alguns questionamentos sobre o ritmo das filas de análise de medicamentos genéricos e similares. Em resposta, a Agência reitera seu compromisso primordial de garantir a segurança, a eficácia e a qualidade dos produtos submetidos à sua análise.
Destaca-se o contínuo esforço para aprimorar os sistemas e procedimentos da Anvisa, visando mais eficiência e transparência em suas atividades. Como exemplo, temos a publicação recente de um painel detalhando as filas internas de cada unidade organizacional envolvida na avaliação de estudos necessários para o registro de medicamentos sintéticos e semissintéticos. Além disso, foi disponibilizado um relatório de gestão ao público, demonstrando a evolução das análises e dos pedidos de registros recebidos pela Agência.
Apesar disso, ainda é relevante contextualizar o aumento significativo no volume de processos priorizados, especialmente na categoria de genéricos, que tem impactado diretamente as análises de pedidos não priorizados de medicamentos genéricos e similares. Embora avanços notáveis tenham sido alcançados na regularização desses casos prioritários, o crescente volume de solicitações dessa natureza tem sobrecarregado os recursos disponíveis para a análise de outros processos. Confira abaixo dois gráficos que ajudam a visualizar a situação.
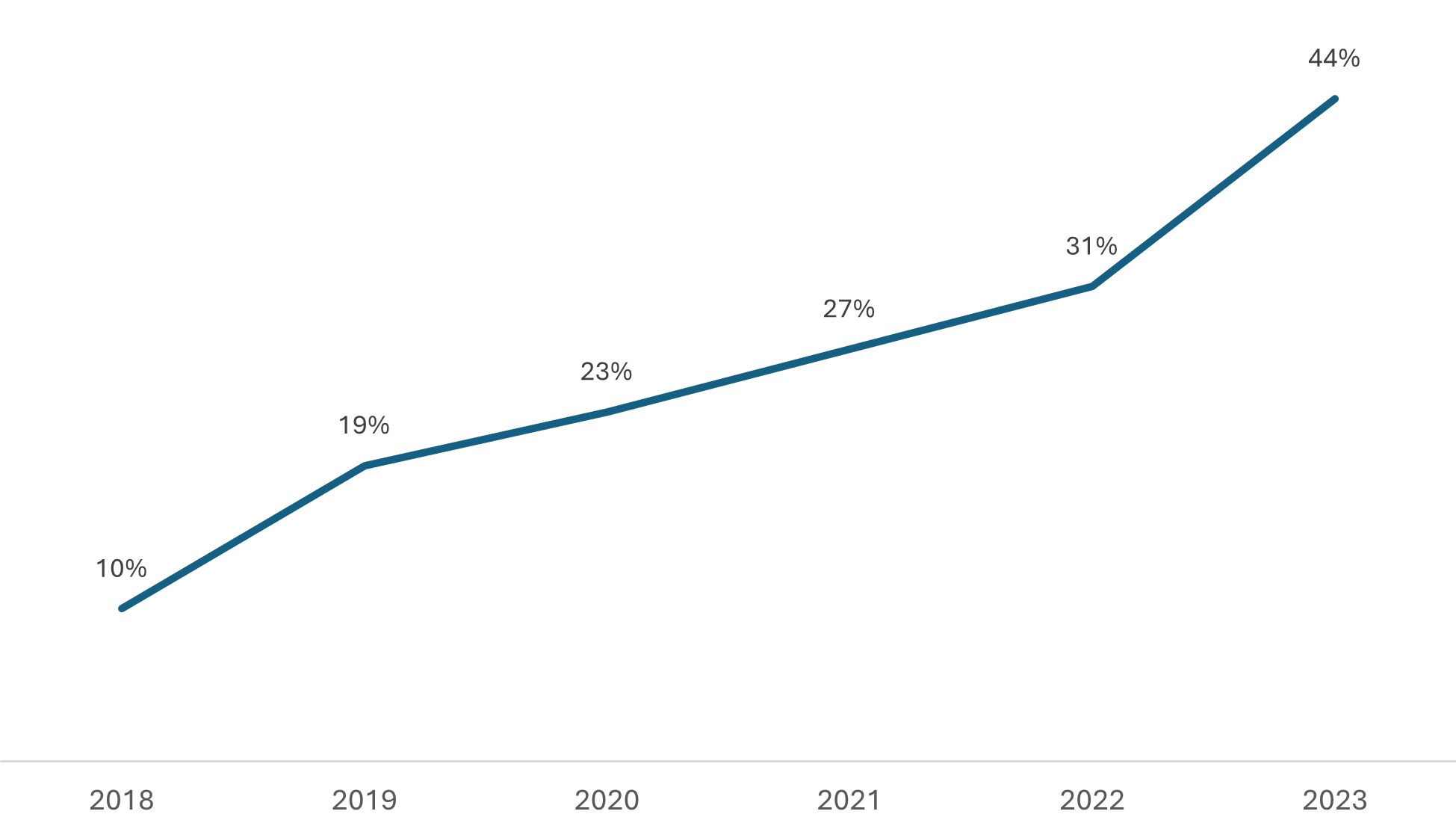
Ocupação da Capacidade de Análise da Gerência de Avaliação da Qualidade de Medicamentos (GQMED) com Processos Priorizados, considerando os recursos humanos atualmente disponíveis.
O Gráfico 1 mostra a ocupação da capacidade de análise da Gerência de Qualidade em Medicamentos (GQMED) com processos de genéricos priorizados ao longo do tempo.
Observa-se a variação na carga de trabalho e como isso tem afetado a capacidade de análise da GQMED.
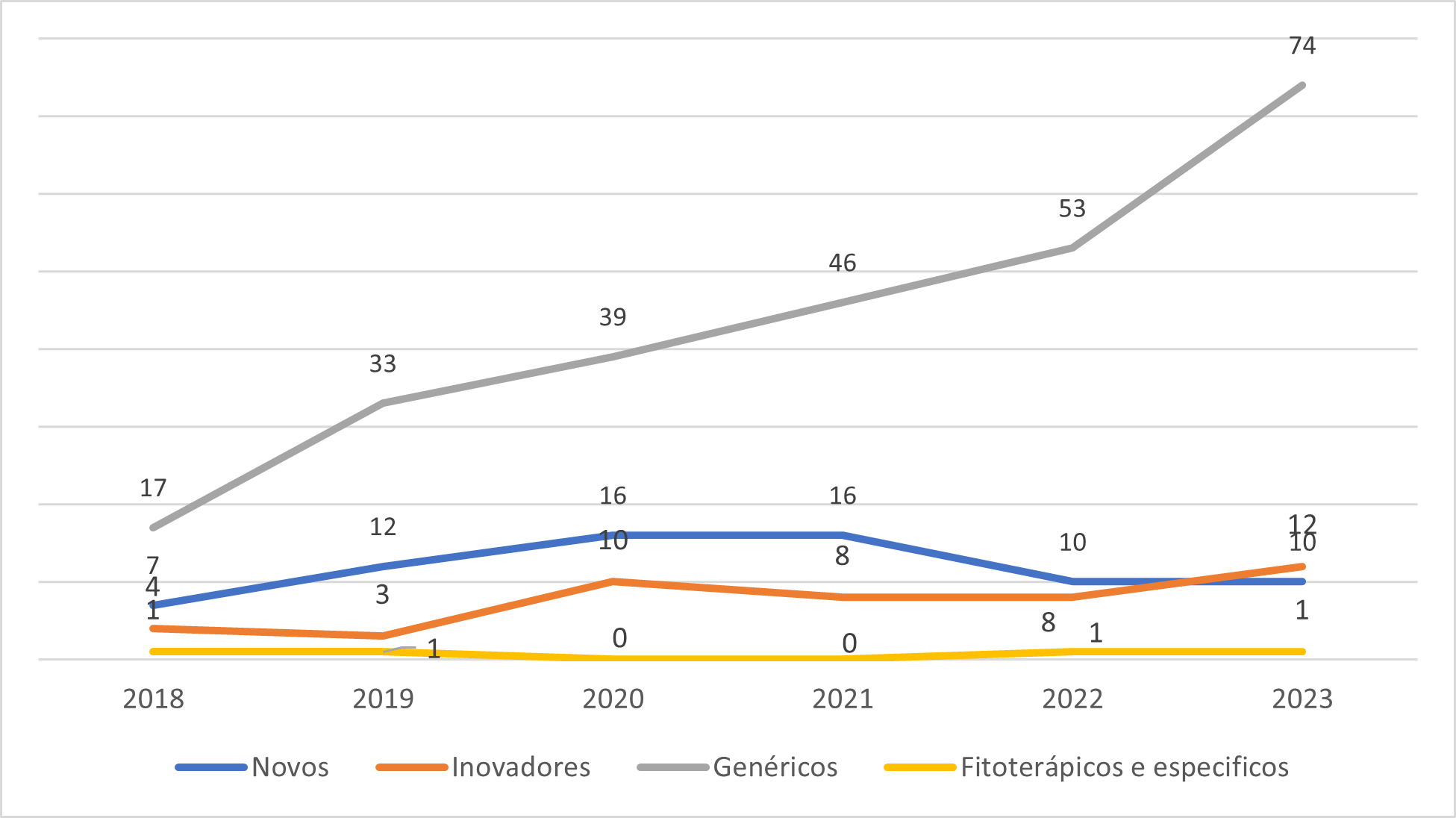
Evolução dos Pedidos de Registros de Medicamentos que tiveram análises priorizadas nos termos das Resoluções RDC 204 e 205, ambas de 2017.
O Gráfico 2 ilustra a evolução dos pedidos de priorização de todos os registros de medicamentos sintéticos e semissintéticos. Destaca-se o aumento significativo na demanda por priorização, especificamente de medicamentos genéricos, o que tem impactado diretamente a dinâmica das análises realizadas pela Anvisa. Esse incremento acentuado também foi observado no ano de 2024, no qual o volume de processos de genéricos priorizados já representa 60% do total previsto para ser analisado no primeiro trimestre.
Portanto, se não houver aumento no número de técnicos responsáveis pelas análises e se for mantido o ritmo de crescimento, que em análise inicial indica um direcionamento da indústria para esse nicho de genéricos priorizados, é esperado que a velocidade de início das análises dos pedidos de registros de medicamentos genéricos e similares não priorizados continue diminuindo.
Por fim, a Anvisa reitera seu compromisso em atuar de forma diligente e responsável na análise dos processos, sempre visando o interesse público e a segurança dos cidadãos.
Anvisa e agência reguladora do Paraguai assinam primeiro Memorando de Entendimento
O documento foi assinado nesta quinta-feira (21/3), na capital paraguaia, Assunção.
A Anvisa assinou o primeiro Memorando de Entendimento com a Direção Nacional de Vigilância Sanitária do Paraguai (Dinavisa). O documento, que visa estabelecer a cooperação técnica entre as duas autoridades, foi assinado pelo diretor-presidente da Anvisa, Antonio Barra Torres, e pelo diretor nacional da Dinavisa, Jorge Silvero.
Na ocasião, as duas autoridades nacionais destacaram a importância dessa cooperação internacional para o fortalecimento da capacidade regulatória, fundamental para a garantia de produtos seguros e eficazes à saúde da população. Além disso, iniciaram as discussões sobre as linhas de cooperação a serem desenvolvidas no âmbito do memorando.
De acordo com o diretor-presidente da Anvisa, além de fortalecer a capacidade regulatória, a cooperação bilateral em vigilância sanitária tem o potencial de promover a integração regional como uma iniciativa concreta. Na opinião de Barra Torres, a medida “irá estabelecer ambientes regulatórios que favoreçam o desenvolvimento econômico e a disponibilidade de produtos mais seguros e de qualidade para a população dos países envolvidos”.

Assinatura do Memorando de Entendimento com a Dinavisa.
Fonte: Anvisa, em 22.03.2024.


