Autorizado concurso com 50 vagas de nível superior para a Anvisa
A Agência tem seis meses para publicar o edital.
O Ministério da Gestão e da Inovação em Serviços Públicos (MGI) publicou, nesta quarta-feira (19/7), uma portaria que autoriza a realização de um concurso público com 50 vagas para o cargo de especialista em regulação e vigilância sanitária (nível superior).
A Agência terá o prazo de seis meses para formar a comissão responsável pelo concurso e publicar o edital de abertura, e mais dois meses para a aplicação das provas após o edital.
Acesse a Portaria MGI 2.853, que autorizou o concurso.
Anvisa aprova Manual da Agenda Regulatória
As diretrizes constantes do manual já serão aplicadas à AR 2024-2025 da Agência.
A Diretoria Colegiada da Anvisa aprovou, na Reunião Ordinária Pública ROP 10/23, realizada nesta quarta-feira (19/7), o Manual da Agenda Regulatória (AR), documento que detalha as diretrizes e o racional que fundamentam o processo de gestão da AR, abrangendo a construção, o planejamento, o monitoramento e a atualização da Agenda Regulatória.
O processo de gestão da AR foi redesenhado, trazendo mudanças no modelo, nos fluxos e na estrutura de governança, com vistas à simplificação administrativa, à economicidade, ao aumento da transparência e da previsibilidade da atuação regulatória, considerando também as adequações necessárias para o alinhamento ao arcabouço normativo federal e as lições aprendidas desde a adoção da primeira AR pela Anvisa, em 2009.
Veja na figura os destaques do modelo de AR abordados pelo Manual.
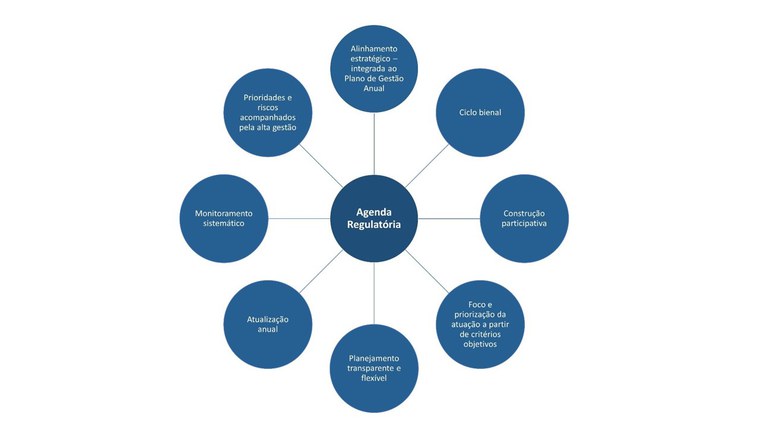
Destaques do modelo de Agenda Regulatória da Anvisa
As diretrizes constantes do Manual já serão aplicadas à próxima AR, cuja construção será iniciada com a realização de consulta externa sobre os temas regulatórios que devem ser tratados pela Agência no biênio 2024-2025.
A consulta será aberta em breve e possibilitará a participação de qualquer interessado.
Fique atento às próximas notícias e participe da construção da nova AR da Anvisa.
Entenda
A AR é um instrumento de planejamento que tem a finalidade de conferir previsibilidade e dar transparência à atividade regulatória normativa.
Ao divulgar antecipadamente os temas regulatórios priorizados para atuação, a AR permite que as partes interessadas se preparem para discutir e se adaptar a possíveis mudanças, contribuindo para a construção de um ambiente regulatório estável.
Guilhotina regulatória revoga normas sobre Covid-19 que perderam a validade
Normas relacionadas à Covid-19 são revogadas após o fim de sua vigência e da situação de Emergência em Saúde Pública de Importância Nacional (ESPIN) e Internacional (ESPII).
A Anvisa aprovou, na reunião pública da Diretoria Colegiada desta quarta-feira (19/7), uma guilhotina regulatória para revogar um conjunto de 15 normas da Anvisa relacionadas à Covid-19 que perderam a sua validade. Grande parte dessas normas teve a sua vigência encerrada em 21 de maio de 2023, um ano depois de serem prorrogadas pela Resolução da Diretoria Colegiada (RDC) 683, de 12 de maio de 2022, publicada em função do encerramento da Emergência em Saúde Pública de Importância Nacional (ESPIN) em decorrência da infecção humana pelo novo coronavírus (2019-nCoV).
Quando a validade de uma norma temporária termina, ela se torna uma norma caduca (sem efeito), mas que se mantém no acervo regulatório até que seja expressamente revogada. Por esse motivo e para manter o estoque atualizado, foi aplicada a guilhotina regulatória, que, por meio da resolução aprovada, revoga um conjunto de normas desatualizadas relativas à Covid-19.
As normas revogadas tratam principalmente de procedimentos excepcionais e temporários adotados durante a pandemia do novo coronavírus, como a importação de vacinas, medidas sanitárias a serem adotadas em aeroportos e aeronaves ou para o embarque, desembarque e transporte de viajantes em navios de cruzeiros. Confira a lista de normas revogadas na guilhotina regulatória.
Lista de normas revogadas
|
NORMAS REVOGADAS – COVID-19 |
|
|
Resolução da Diretoria Colegiada (RDC) |
Assunto |
|
Suspende os efeitos da RDC 302, de 13 de outubro de 2005, em caráter temporário e excepcional, para os Laboratórios Federais de Defesa Agropecuária (LFDAs) que irão realizar análises para o diagnóstico da Covid-19. |
|
|
Define os critérios e os procedimentos extraordinários e temporários para a aplicação de excepcionalidades a requisitos específicos de rotulagem e bulas de medicamentos, em virtude da emergência de saúde pública internacional decorrente do novo coronavírus. |
|
|
Estabelece a abertura temporária de pontos de entrada e saída de substâncias sujeitas a controle especial, em virtude da Emergência de Saúde Pública de Importância Internacional (ESPII) relacionada ao novo coronavírus (Sars-CoV-2). |
|
|
Dispõe sobre as medidas a serem adotadas em aeroportos e aeronaves em virtude da publicação da Portaria GM/MS 913, de 22 de abril 2022, do ministro de Estado da Saúde, que declara o encerramento da Emergência em Saúde Pública de Importância Nacional (ESPIN) em decorrência da infecção humana pelo novo coronavírus (Sars-CoV-2). |
|
|
Estabelece a dispensa de registro e da autorização de uso emergencial e os procedimentos para importação e monitoramento das vacinas Covid-19 adquiridas pelo Ministério da Saúde, no âmbito do Instrumento de Acesso Global de Vacinas Covid-19 (Covax Facility) para o enfrentamento da emergência de saúde pública de importância nacional decorrente do surto do novo coronavírus (Sars-CoV-2). |
|
|
Altera a RDC 456, de 17 de dezembro de 2020, que dispõe sobre as medidas a serem adotadas em aeroportos e aeronaves em virtude da situação de Emergência em Saúde Pública de Importância Nacional decorrente do surto do novo coronavírus - Sars-CoV-2. |
|
|
Dispõe sobre proibições para as importações realizadas por pessoa física para uso próprio por quaisquer modalidades de importação durante a pandemia do novo coronavírus. |
|
|
Estabelece procedimentos excepcionais e temporários para importação das vacinas Covid-19 regularizadas na Anvisa e seus insumos para o enfrentamento da emergência de saúde pública de importância nacional decorrente do surto do novo coronavírus (Sars-CoV-2). |
|
|
Dispõe, de forma extraordinária e temporária, sobre a permissão de uso dos medicamentos e produtos biológicos utilizados no tratamento e prevenção da Covid-19, provenientes do estoque remanescente dos ensaios clínicos conduzidos ou em andamento no Brasil, em virtude da emergência de saúde pública de importância nacional decorrente do surto do novo coronavírus (Sars-CoV-2). |
|
|
Define os critérios e os procedimentos extraordinários e temporários para a certificação de boas práticas de fabricação para fins de registro e alterações pós-registro de insumo farmacêutico ativo, medicamento e produtos para saúde em virtude da emergência de saúde pública internacional do novo coronavírus. |
|
|
Define os critérios e os procedimentos extraordinários e temporários para a fabricação e a comercialização de preparações antissépticas ou sanitizantes oficinais sem prévia autorização da Anvisa e dá outras providências, em virtude da emergência de saúde pública internacional relacionada ao Sars-CoV-2. |
|
|
Prorroga a vigência de RDCs, em virtude da publicação da Portaria GM/MS 913, de 22 de abril de 2022, do ministro de Estado da Saúde, que declara o encerramento da Emergência em Saúde Pública de Importância Nacional (ESPIN) em decorrência da infecção humana pelo novo coronavírus (2019-nCoV). |
|
|
Altera a RDC 456, de 17 de dezembro de 2020, que dispõe sobre as medidas a serem adotadas em aeroportos e aeronaves em virtude da situação de Emergência em Saúde Pública de Importância Nacional decorrente do surto do novo coronavírus - Sars-CoV-2. |
|
|
Dispõe sobre os procedimentos e os requisitos para a manutenção das autorizações já concedidas e para os novos pedidos de autorização temporária de uso emergencial (AUE), em caráter experimental, de medicamentos e vacinas contra a Covid-19 para o enfrentamento da pandemia de Sars-CoV-2. |
|
|
Altera a RDC 456, de 17 de dezembro de 2020, que dispõe sobre as medidas a serem adotadas em aeroportos e aeronaves em virtude da publicação da Portaria GM/MS 913, de 22 de abril 2022, do ministro de Estado da Saúde, que declara o encerramento da Emergência em Saúde Pública de Importância Nacional (ESPIN) em decorrência da infecção humana pelo novo coronavírus (Sars-CoV-2). |
|
Guilhotina regulatória
A guilhotina regulatória é um mecanismo que promove a atualização e a simplificação do estoque regulatório, revogando expressamente atos normativos obsoletos (desatualizados ou ultrapassados). Seu objetivo é retirar do estoque regulatório as normas que não têm mais validade, tornando o acervo regulatório da Anvisa mais enxuto, organizado e acessível.
A Agência já realizou cinco guilhotinas regulatórias desde 2016, resultando na revogação de 1.016 normas, o que representa um quantitativo maior que as atuais 914 normas componentes do estoque regulatório da Agência (vide Painel do Estoque Regulatório). A última guilhotina realizada pela Anvisa foi em dezembro de 2020 e fez parte do primeiro ciclo do projeto de revisão e consolidação de normas promovido pelo Decreto 10.139/19. Naquela ocasião, a guilhotina promoveu a revogação de 722 atos normativos através da publicação da RDC 454, de 17 de dezembro de 2020.
Anvisa aprova Avaliação de Resultado Regulatório
Relatório apresenta resultados da avaliação de processo da implementação da RDC 478, de 2021, que dispõe sobre o monitoramento econômico de dispositivos médicos (DMs).
A Diretoria Colegiada da Anvisa aprovou, nesta quarta-feira (19/7), a Avaliação de Resultado Regulatório (ARR), nos moldes do Decreto 10.411/2020. O documento avalia a implementação da RDC 478, de 12 de março de 2021, que dispõe sobre o monitoramento econômico de dispositivos médicos, ato normativo que consta da Agenda de ARR 2023/2026 da Anvisa.
Entenda
O monitoramento econômico de dispositivos médicos (DMs) se refere ao acompanhamento contínuo de preços, bem como de outros dados econômicos que sejam relevantes para contribuir para a redução da assimetria de informação nesse mercado. Isso permite maior equilíbrio nos níveis de informação que compradores, prescritores e fornecedores têm sobre os DMs monitorados.
Para tanto, a RDC 478/2021 definiu um modelo de monitoramento econômico baseado no acompanhamento dos preços efetivamente praticados no mercado, a serem divulgados na forma de estatísticas do histórico desses preços no período monitorado, por meio de ferramenta que permita, também, o agrupamento de DMs com características técnicas semelhantes.
Para tanto, foi realizada uma avaliação de processo, com o objetivo de obter: (i) informações sobre a implementação das ações previstas e se ocorreram com a qualidade, a quantidade e a tempestividade esperadas; (ii) evidências sobre pontos fortes e fraquezas da implementação do monitoramento econômico de dispositivos médicos; e (iii) subsídios para a simplificação e a otimização do monitoramento econômico de dispositivos médicos.
A avaliação foi estruturada em torno de quatro critérios, que agregaram oito questões de ARR e seis indicadores. Os resultados obtidos indicaram que a implementação da RDC 478/2021 ocorreu da forma desejada e a adesão dos detentores de registro dos DMs monitorados teve desempenho considerado suficiente.
Norma padrão ouro
A RDC 478/2021 foi uma das normas da Anvisa que recebeu o Selo Ouro de Boas Práticas Regulatórias, sendo reconhecida pela excelência em sua elaboração, de acordo com as melhores práticas regulatórias. A classificação dos atos é feita pelo Ministério do Desenvolvimento, Indústria, Comércio e Serviços (MDIC), que instituiu, em abril de 2023, o Selo de Boas Práticas Regulatórias. Entre os dez critérios avaliados estão a previsibilidade, a qualidade regulatória, a participação social e a convergência regulatória.
O que é ARR?
Segundo o Decreto 10.411/2020, ARR é a verificação dos efeitos decorrentes da edição de um ato normativo, considerados o alcance dos objetivos originalmente pretendidos e os demais impactos observados sobre o mercado e a sociedade, em decorrência de sua implementação.
Qual a importância de se realizar a ARR?
A importância é refletida em seus principais objetivos, que são: avaliar a implementação dos atos normativos; avaliar os resultados e impactos (esperados e inesperados) do instrumento regulatório; verificar se o instrumento regulatório foi eficaz, efetivo e eficiente no cumprimento de seus objetivos; e verificar se há necessidade de ajuste ou de revogação.
As práticas de ARR integram o ciclo regulatório da Anvisa, que se completa quando a capacidade de avaliar permite a aprendizagem da instituição e auxilia no processo de tomada de decisão, para o aprimoramento constante da atuação regulatória, a partir dos resultados produzidos.
Clique aqui e confira a íntegra do documento.
Saiba mais
Legislação
Confira também a Agenda de ARR 2023-2026
Importação de produtos da medicina tradicional chinesa: entenda
A Anvisa preparou este texto para esclarecer, de forma objetiva, o que é exigido e dispensado na aquisição de insumos.
Apesar de os produtos da medicina tradicional chinesa (MTC) não necessitarem de registro ou notificação, as empresas estabelecidas no país que adquiram insumos para utilização em produtos da MTC devem cadastrar, junto à Anvisa, todos os insumos farmacêuticos ativos com os quais trabalham.
Após o cadastramento, os produtos da MTC importados devem seguir o procedimento “5.3 – Medicamentos (Subseção III, Seção IX, Procedimento 5, Outros produtos)”, regulamentado pela Resolução da Diretoria Colegiada (RDC) 81/2008, que trata sobre bens e produtos importados para fins de vigilância sanitária.
As importadoras de produtos pertencentes à MTC estão dispensadas da exigência de Autorização de Funcionamento (AFE), conforme estabelecido no art. 3º da RDC 16/2014.
Atenção! É obrigatório abrir protocolo de petição de fiscalização sanitária para importação, no sistema Solicita, a partir do módulo LPCO do Portal Único de Comércio Exterior, de acordo com as instruções dispostas na Cartilha do Peticionamento de Licença de Importação por meio de LPCO.
Deseja obter outros esclarecimentos sobre as ações de fiscalização de produtos da medicina tradicional chinesa? Acesse a página do seminário virtual sobre o tema. Nela você encontrará a gravação do evento, bem como a apresentação realizada pela Anvisa durante o encontro e a 1ª edição das Perguntas e Respostas sobre o tema.
MTC: o que é
Segundo a definição da RDC 21/2014, são considerados produtos da medicina tradicional chinesa (MTC) as formulações obtidas a partir de matérias-primas de origem vegetal, mineral e cogumelos (fungos macroscópicos, de acordo com as técnicas da MTC e integrantes da Farmacopeia Chinesa.
Fonte: Anvisa, em 20.07.2023.


