Anvisa e Unesco selecionam três consultores para Secretaria Geral da Diretoria Colegiada
O período para recebimento dos currículos começa neste sábado (16/8) e vai até o dia 20 de agosto. Participe!
O projeto de cooperação técnica internacional entre a Anvisa e a Organização das Nações Unidas para a Educação, a Ciência e a Cultura (Unesco) seleciona três consultores técnicos especializados, por tempo limitado.
As vagas são para os perfis profissionais das áreas de administração, direito e ciência de dados. Os selecionados irão atuar na Secretaria Geral da Diretoria Colegiada (SGCOL).
Saiba mais no Portal da Unesco ou nos editais abaixo:
Edital nº 11/2025 – Administração
Edital nº 12/2025 – Ciência de Dados, Estatística, Engenharia de dados, ou áreas afins.
Se o seu perfil profissional se adequa ao edital, favor anexar seu currículo e as documentações comprobatórias na Plataforma Roster da Unesco – site: https://roster.brasilia.unesco.org/app/selection-process-list , conforme orientação dos editais.
O período para preenchimento do formulário disponibilizado no edital será de 16/08/25 a 20/08/2025.
Solicitações de Certificado de Regularização e Certidão de Regularização
para Exportação de Medicamento Notificado têm novo fluxo
Pedidos deverão ser enviados via peticionamento eletrônico.
A Anvisa informa que já está em vigor o novo fluxo para solicitar o Certificado de Regularização para Medicamento Notificado e a Certidão de Regularização para Exportação de Medicamento Notificado. Ambos são documentos declaratórios emitidos pela Agência contendo informações sobre determinado medicamento notificado no Brasil, sendo que a certidão se destina exclusivamente à exportação.
Atualmente, as empresas fazem a solicitação de emissão desses documentos por e-mail. Para fins administrativos e em conformidade com os demais fluxos da Anvisa, a partir de agora a solicitação deverá ser realizada via peticionamento eletrônico, como já ocorre em relação à emissão de Certificado de Registro para Medicamentos.
Para tanto, deverão ser utilizados os seguintes assuntos de petição:
- 12392 GGMED – Certidão de Regularização para Exportação de Medicamento Notificado
- 12393 GGMED – Certificado de Regularização para Medicamento Notificado
Os prazos e demais requisitos para a emissão dos documentos em questão permanecem inalterados.
Acesso ao SNGPC será facilitado pela plataforma Gov.Br
Objetivo da nova forma de acessar o sistema é melhorar a experiência dos usuários.
O acesso ao Sistema Nacional de Gerenciamento de Produtos Controlados (SNGPC) agora também pode ser feito pela plataforma Gov.Br, além da forma de acesso já disponível pelo link https://sngpc.anvisa.gov.br/. Essa é mais uma medida de melhoria no sistema, visando aprimorar continuamente a experiência dos usuários.
Ao utilizar a plataforma Gov.Br, o responsável legal ou responsável técnico deve utilizar as próprias credenciais de acesso no Gov.Br para acessar o SNGPC, eliminando a necessidade de utilizar um nome de usuário e senha específicos. Com isso, o próprio usuário poderá a fazer a gestão das suas credenciais de acesso, conferindo maior agilidade às operações necessárias.
Destaca-se ainda que não é necessário realizar nenhuma alteração no cadastro atual dos usuários do sistema para acessar o SNGPC através da plataforma Gov.Br. A forma de cadastro das farmácias e seus usuários permanece a mesma, seguindo os passos disponíveis em https://www.gov.br/anvisa/pt-br/sistemas/cadastro/cadastro-de-empresas
Webinar orienta sobre como participar da construção da Agenda Regulatória 2026-2027
Encontro será no dia 21 de agosto, às 15h. Participe!
Na próxima quinta-feira (21/8), a Anvisa irá realizar o webinar "Construção da Agenda Regulatória 2026-2027: Edital da lista preliminar de temas''.
No encontro, serão apresentados à sociedade os principais elementos da AR 2026-2027, juntamente com as orientações para o envio de contribuições à lista preliminar de temas.
Para participar do evento, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio
Dia 21/8, às 10h – Webinar – Construção da Agenda Regulatória 2026-2027: Edital da lista preliminar de temas.
Webinar
É um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizados ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento.
Confira a página específica de webinares realizados pela Agência.
Anvisa recebe embaixador da Índia para discutir cooperação no setor farmacêutico
A Anvisa recebeu, nesta quinta-feira (14/8), a visita do embaixador da Índia no Brasil, Dinesh Bhatia. O encontro foi conduzido pelo diretor-presidente substituto, Rômison Rodrigues Mota, na sede da Agência, em Brasília.
A reunião abordou a relevância da indústria farmacêutica indiana e aspectos regulatórios relacionados ao fornecimento de medicamentos e dispositivos médicos. O embaixador manifestou interesse em estreitar o diálogo com a Anvisa e solicitou esclarecimentos sobre aspectos regulatórios aplicáveis a esses produtos no Brasil.
A Agência apresentou um panorama de suas atribuições na regulação sanitária de produtos médicos, bem como dados sobre inspeções realizadas na Índia nos anos de 2024 e 2025.
Também foi discutido o interesse de empresas indianas em estabelecer parcerias para o desenvolvimento produtivo (PDPs) com empresas brasileiras, iniciativa que poderá contribuir para a geração de empregos e para a ampliação do acesso da população a produtos estratégicos para a saúde.
O encontro reforça o papel da Anvisa no diálogo internacional e na promoção de ações que favoreçam a saúde pública, alinhadas a padrões regulatórios reconhecidos globalmente.

Diretor-presidente substituto da Agência, Rômison Rodrigues Mota, e o embaixador da Índia no Brasil, Dinesh Bhatia.
Agenda Regulatória 2026-2027: lista preliminar de temas está aberta para contribuições
Edital dá início ao processo de construção dos temas que serão prioritários nos próximos dois anos.
De 15 de agosto a 15 de setembro, a sociedade e os entes do Sistema Nacional de Vigilância Sanitária (SNVS) poderão opinar sobre a lista preliminar de temas propostos pela Anvisa para priorização na Agenda Regulatória (AR) 2026-2027. Neste período, também será possível sugerir a inclusão de outros temas, caso alguma demanda regulatória de interesse não esteja presente na lista.
As contribuições poderão ser enviadas por meio de formulário eletrônico aberto à participação de qualquer interessado, conforme divulgado no Edital de Chamamento 10, de 14/8/2025. O formulário permite escolher um macrotema por vez, ou seja, as contribuições devem ser realizadas para cada área/assunto de atuação da Anvisa, como por exemplo um formulário para os temas de alimentos e um novo formulário para os temas de medicamentos.
Para que essa participação seja efetiva, as contribuições devem ser claras e bem-motivadas pelos interessados, conforme orientações que constam no manual com instruções para participação. Quanto mais bem embasadas, mais as manifestações podem contribuir para a análise das unidades técnicas da Agência, que serão responsáveis pela priorização e seleção dos temas, conforme estabelecido no Manual da AR.
Lista preliminar
Um conjunto de 115 temas regulatórios estão presentes na lista preliminar da AR 2026-2027, sendo 97 migrados da Agenda 2024-2025 e 18 novos temas sugeridos pelas áreas técnicas da Anvisa. A lista preliminar pode ser conferida em sua versão resumida, no formato pdf, ou em versão detalhada, disponível em lista para baixar em planilha excel.
Ressalta-se que a consulta sobre a lista preliminar da Agenda representa um momento de coleta de contribuições para apoiar a construção da lista final de temas, que deverá ser aprovada pela Diretoria Colegiada da Anvisa no fim deste ano. Portanto, não se trata ainda da lista final de temas da Agenda Regulatória 2026-2027.
Webinar de orientações
Na próxima quinta-feira (21/8), às 10h, será realizado o webinar “Construção da Agenda Regulatória 2026-2027: Edital da lista preliminar de temas''. Na ocasião, os principais elementos da AR 2026-2027 serão apresentados à sociedade, juntamente com as orientações para o envio de contribuições lista preliminar de temas. Para participar do webinar, não é necessário cadastro prévio: basta acessar este link, no dia e horário marcados.
Entenda a Agenda
A Agenda Regulatória (AR) é um instrumento de planejamento que tem a finalidade de conferir previsibilidade e dar transparência à atividade regulatória normativa. Ao divulgar antecipadamente os temas regulatórios priorizados para atuação, a Agenda permite que as partes interessadas se preparem para discutir e se adaptar a possíveis mudanças, contribuindo para a construção de um ambiente regulatório estável.
A construção participativa da AR é uma diretriz de destaque na Anvisa, sendo um reflexo do valor contributivo da sociedade para o alinhamento da atuação regulatória da Agência em sua missão de proteger e promover a saúde da população.
Operação desarticula rede suspeita de falsificar medicamento para câncer no Ceará
Ação foi uma parceria da Anvisa com a Secretaria de Saúde do Ceará e a Agência de Fiscalização de Fortaleza.


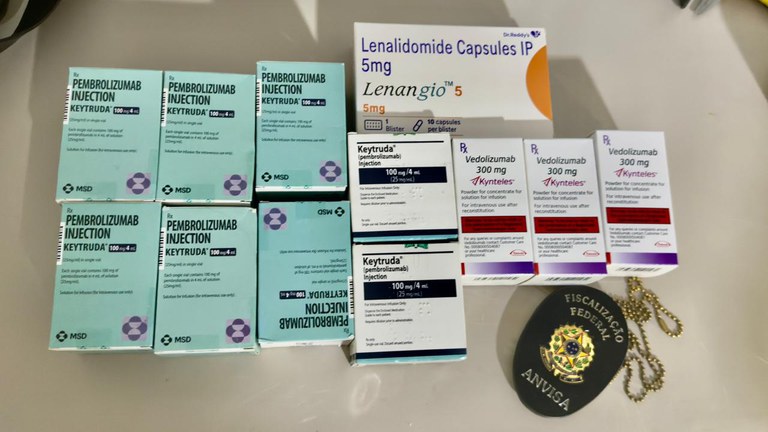



A Anvisa realiza, desde a quarta-feira (13/8), uma operação de combate à falsificação de medicamentos no estado do Ceará. O foco da ação é desarticular uma rede suspeita de distribuição e venda de versões falsificadas do medicamento injetável Keytruda para hospitais e clínicas de saúde. A operação foi feita em parceria com a Secretaria de Saúde do Ceará e a Agência de Fiscalização de Fortaleza (Agefis).
O medicamento original (princípio ativo pembrolizumabe) é um imunoterápico de alto custo usado no tratamento de diversos tipos de câncer, como melanoma, câncer de pulmão, câncer de cabeça e pescoço, câncer esofágico, linfoma de Hodgkin clássico e outros. A circulação de versões falsificadas pode comprometer o tratamento dos pacientes e provocar eventos adversos (ocorrências médicas indesejadas).
Após a investigação de denúncias, os fiscais chegaram a uma distribuidora de medicamentos regularizada que estaria fornecendo as versões falsificadas, mas foram impedidos de entrar no local por um funcionário. Como a fiscalização foi obstruída, a empresa foi interditada até a conclusão das investigações. Com auxílio policial, o funcionário foi encaminhado à Polícia Civil para prestar depoimento. Também foi necessária a expedição de um mandado judicial para ingressar na distribuidora com auxílio policial, a fim de verificar as mercadorias existentes, o que ocorreu às 6h da manhã desta sexta-feira (15/8).
No local, os fiscais encontraram diversas caixas de medicamentos sem registro no Brasil, com rotulagem em inglês, incluindo caixas do medicamento Keytruda, o que levanta suspeitas de falsificação internacional. Havia diversas notas fiscais comprovando a venda desses medicamentos sem registro, além de caixas de medicamentos biológicos também sem registro no país. O registro sanitário de um medicamento é um mecanismo de controle que garante que o produto possui eficácia e segurança comprovadas, tendo passado pelos testes necessários. Quando um medicamento não possui registro, não há como saber a sua procedência e em que condições foi fabricado, nem garantir o que há no conteúdo.
A falsificação de medicamentos pode ser considerada crime hediondo pelo Código Penal, com penas que vão de 10 a 15 anos de prisão, especialmente nos casos dos medicamentos chamados “life saving”, ou seja, considerados de alta importância para a saúde pública.
Histórico
Em junho deste ano, a Anvisa recebeu uma queixa técnica de um hospital localizado em Palmas (TO) sobre problemas com frascos do lote SO48607 do Keytruda, tendo como data de fabricação 20/04/2024 e prazo de validade 19/04/2028, adquiridos de uma distribuidora regularizada. A nota fiscal não informava sobre lote e validade do medicamento e o hospital notou problemas no transporte, como a falta de controle de temperatura dos produtos. Além disso, as embalagens tinham aspecto diferente das embalagens usuais.
A Agência solicitou esclarecimentos da distribuidora e determinou que fosse suspensa a venda de qualquer unidade do medicamento, não tendo ocorrido retorno da empresa.
Paralelamente, a detentora do registro do medicamento no Brasil, Merck Sharp & Dohme, informou não reconhecer o lote citado, com rótulo em inglês e um falso selo de segurança feito com efeito holográfico e escrito em árabe, tratando-se de caso de falsificação que foi reportado pela Anvisa à Organização Mundial da Saúde (OMS).
Caso em investigação
Em julho, a Agência recebeu nova denúncia por parte de um serviço hospitalar de Vitória da Conquista (BA), que adquiriu da mesma distribuidora unidades do lote YO19148 tendo como data de fabricação 31/07/2024 e validade 30/07/2026. As embalagens eram diferentes da embalagem tradicional do medicamento e não possuíam o número de registro na Anvisa. Esse caso ainda segue em investigação.
Fonte: Anvisa, em 15.08.2025.


