Publicado edital para especialização em ciência de dados
Podem se inscrever servidores efetivos da Anvisa, MS, ANS, Funasa, Fiocruz e de órgãos de vigilância sanitária estaduais e municipais.
A Anvisa informa que foi publicado o edital para seleção do Curso de Especialização em Ciência de Dados e Inteligência Artificial – Lato Sensu. Serão oferecidas 60 vagas, destinadas exclusivamente a servidores efetivos da Anvisa, do Ministério da Saúde ou de órgão vinculado (Agência Nacional de Saúde Suplementar – ANS, Fundação Nacional de Saúde – Funasa e Fundação Oswaldo Cruz – Fiocruz) e de órgãos de vigilância sanitária estaduais ou municipais. As inscrições podem ser realizadas a partir de segunda-feira (9/5) até as 14h do dia 24/5, horário de Brasília.
A especialização foi viabilizada por meio de uma parceria com o Ministério da Saúde e o Hospital Alemão Oswaldo Cruz (HAOC), no âmbito do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (Proadi-SUS).
O curso será ministrado na modalidade presencial, com aulas síncronas e imersões presenciais, num total de 360 horas. As vagas serão divididas em duas turmas, cada uma delas com 30 alunos. A primeira turma terá início no dia 22 de junho deste ano e término em 5 de maio de 2023. A segunda turma será realizada de 29 de junho deste ano a 12 de maio de 2023.
O quadro de distribuição das vagas e outras informações estão reunidas no edital. Confira e participe!
Anvisa participará de reunião do ICH com reguladores internacionais
As atividades serão realizadas de forma presencial – pela primeira vez desde novembro de 2019 –, entre 21 e 26 de maio.
A Anvisa participará da 44ª Reunião do Conselho Internacional de Harmonização de Requisitos Técnicos para Produtos Farmacêuticos de Uso Humano (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use – ICH). As atividades ocorrerão de forma presencial – pela primeira vez desde novembro de 2019 –, entre os dias 21 e 26 de maio, em Atenas, na Grécia.
A delegação brasileira, composta por nove representantes, fará parte das reuniões da Assembleia, do Comitê Gestor e de seis dos sete grupos de trabalho que estarão reunidos presencialmente de forma síncrona. Os representantes da Agência foram designados conforme os documentos de Governança do Conselho e a Portaria 1520/2019, que trata do modelo de atuação regulatória para a incorporação de temas desenvolvidos pelo ICH.
Paralelamente às reuniões do ICH, haverá a reunião do Programa Internacional de Reguladores Farmacêuticos (International Pharmaceutical Regulators Programme – IPRP), que reúne exclusivamente autoridades reguladoras para o intercâmbio de informações e questões de mútuo interesse, promovendo a cooperação entre os membros. A Anvisa ocupa hoje a vice-presidência do Comitê Gestor do IPRP.
Saiba mais
O ICH é uma iniciativa que reúne autoridades regulatórias e a indústria farmacêutica para discutir aspectos científicos e técnicos do desenvolvimento e registro de produtos farmacêuticos. Além do Brasil, são membros as autoridades reguladoras da União Europeia, Estados Unidos, Japão, Canadá, Suíça, México, Singapura, Coréia do Sul, China, Arábia Saudita, Taipé Chinesa e Turquia.
Em 2019, a Anvisa foi eleita para o Comitê Gestor do ICH, que tem como função propor à Assembleia a deliberação dos temas prioritários para harmonização e treinamento, a supervisão dos grupos de trabalho, bem como as decisões de governança do Conselho.
Para mais informações sobre o ICH e a atuação da Agência no Conselho, participe da XIII edição do webinar “Diálogos Regulatórios Internacionais”, que será realizado no dia 12 de maio, a partir das 15h.
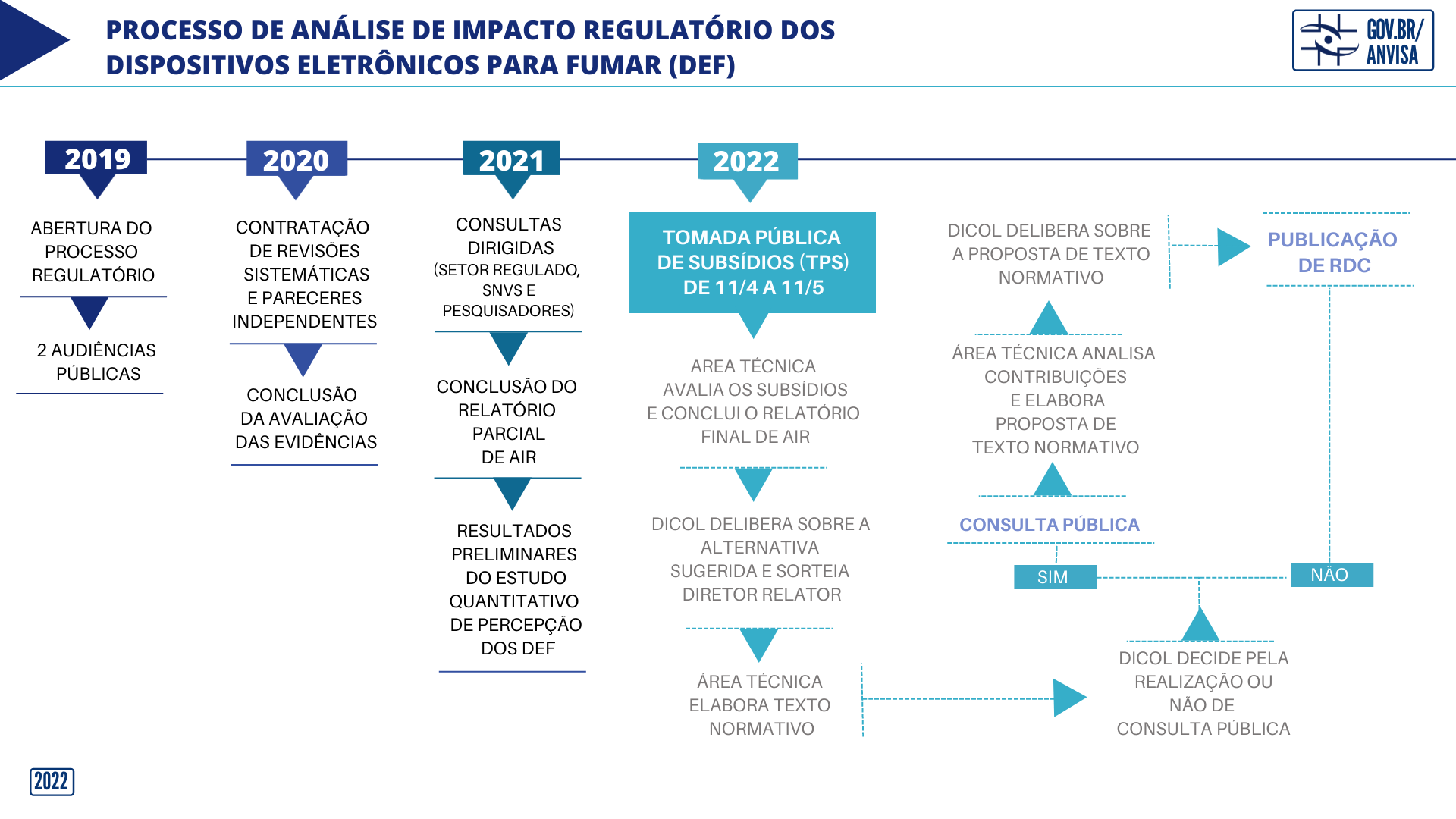
Anvisa prorroga prazo para receber informações técnicas sobre dispositivos eletrônicos para fumar
Tomada Pública de Subsídios tem prazo prorrogado por 30 dias.
A Anvisa prorrogou por 30 dias o prazo final para o recebimento de contribuições da Tomada Pública de Subsídios (TPS) 6/2022. Com a prorrogação, o prazo de encerramento da TPS passa a ser o próximo dia 10 de junho. Assim, os interessados poderão enviar à Agência contribuições e evidências técnicas e científicas sobre os dispositivos eletrônicos para fumar (DEFs), também conhecidos como cigarros eletrônicos.
A prorrogação atende solicitações de diversos segmentos e tem como objetivo permitir que haja mais tempo para a participação de um maior número de interessados, que não tiveram a possibilidade de se aprofundar no Relatório Parcial de AIR para o envio de suas contribuições à TPS nos 30 dias inicialmente concedidos. Com a prorrogação, o prazo total de participação social será de 60 dias. A realização da etapa de TPS não é obrigatória, mas é considerada pela Anvisa uma ferramenta importante para a transparência do processo e o incentivo à ampla participação social.
Saiba mais sobre os DEFs
Os dispositivos eletrônicos para fumar foram proibidos no país pela Resolução da Diretoria Colegiada (RDC) 46/2009. Em 2019, a Agência iniciou um processo regulatório para discussão e atualização das informações técnicas sobre o tema. Todas as etapas realizadas, bem como as que estão em andamento, podem ser conhecidas na página da área de tabaco.
Saiba mais sobre a TPS
A Tomada Pública de Subsídios consiste em uma etapa de participação social por meio da qual qualquer interessado pode enviar contribuições. A Anvisa apresenta um documento técnico (Relatório Parcial de Análise de Impacto Regulatório) e um formulário para o envio dessas contribuições ao Relatório.
Portanto, a TPS faz parte do processo de Análise de Impacto Regulatório (AIR) das Boas Práticas de Regulamentação da Agência (art. 28 da Portaria PT 162/2021). As contribuições são recebidas por escrito, de forma on-line, e é permitida apenas uma participação por interessado.
É importante destacar que, embora qualquer interessado possa participar dessa etapa, não se trata de uma votação ou enquete. O objetivo da TPS, como já mencionado, é reunir evidências técnicas e científicas.
Diferentemente das consultas públicas, que já exibem um texto pronto de minuta de norma para contribuição, a TPS é realizada em um momento anterior, quando a Anvisa apresenta à sociedade o relatório sobre o problema. Esse relatório não representa qualquer decisão por parte da Agência. As decisões da Diretoria Colegiada irão ocorrer em etapas posteriores à realização da TPS.
Vale ressaltar que a TPS não é o último mecanismo de participação social no processo regulatório. Concluída a AIR, caso se decida pela elaboração de ato normativo, a minuta ainda pode ser colocada em consulta pública, garantindo a transparência e o diálogo aberto com a sociedade desde as etapas iniciais até o final do processo.
Clique aqui para acessar a TPS 6/2022.
Anvisa atualiza sistema de consulta de filas e listas de análise
Medida traz novas funcionalidades e torna as informações mais transparentes. Entenda!
A Anvisa informa que atualizou, no final de abril, o sistema de consulta de filas e listas de análise de petição. A medida tem como objetivo trazer melhorias de navegação e transparência da informação.
Confira as principais mudanças:
- Um link fixo e de fácil acesso ao painel de Business Intelligence (BI), que elenca todos os assuntos e situações que compõem cada fila ou lista.
- Um indicador da data e hora da última atualização da base de dados.
- Links diretos nos resultados para a consulta de situação de documentos para cada expediente e processo.
- Possibilidade de exportação, em formato de planilha (XLS), dos resultados em tela.
Essas alterações já estão disponíveis no sistema e fazem parte da ação contínua da Agência voltada à transparência ativa, provendo mais meios e informações aos usuários.
Caso você encontre alguma inconsistência, a Anvisa solicita a gentileza de entrar em contato com a área técnica responsável, utilizando nossos canais de atendimento.
Fonte: Anvisa, em 06.05.2022.


