Anvisa aprova uso emergencial do medicamento molnupiravir para Covid-19
Medicamento é indicado a pacientes adultos que não requerem oxigênio suplementar e apresentam risco de progressão para a forma grave de Covid-19.
ADiretoria Colegiada da Anvisa aprovou, nesta quarta-feira (4/5), o uso emergencial do medicamento molnupiravir, da empresa Merck Sharp & Dohme (MSD), para tratamento da Covid-19. O pedido foi avaliado pelos diretores durante a 7ª Reunião Extraordinária Pública, realizada por meio de videoconferência e transmitida ao vivo.
O molnupiravir é um medicamento antiviral de uso oral que, nos ensaios clínicos, mostrou efeitos benéficos a pacientes adultos leves e moderados, com capacidade de reduzir os casos de hospitalização e mortes. De uso domiciliar, ele funciona de modo a reduzir as chances do vírus Sars-CoV-2 se multiplicar e reproduzir no corpo.
No cenário internacional, o medicamento já foi aprovado nos Estados Unidos (FDA), na Europa (EMA), no Japão, no Reino Unido, na Austrália e também pela Organização Mundial da Saúde, a OMS, e está em uso em 17 países.
A diretora Meiruze Freitas, relatora do processo, ao votar pela aprovação do medicamento, explicou que é importante ter opções terapêuticas para determinadas condições clínicas, especialmente em indivíduos que, por várias razões, têm alto risco de desenvolver as formas graves de Covid-19. A diretora relatora, contudo, chamou a atenção que o molnupiravir não é um substituto das vacinas contra Covid-19 e que a vacina continua sendo a melhor opção para prevenir a doença.
“Reitero que a vacinação continua sendo a melhor estratégia para evitar a Covid-19 grave, hospitalizações e óbitos. Aqueles que não completaram o curso completo de vacinação têm mais chances de apresentar sintomas moderados ou graves em comparação com aqueles que receberam um reforço, especialmente os mais vulneráveis”, afirmou Meiruze Freitas, que destacou também a necessidade de que a comunidade científica, a indústria farmacêutica, os reguladores e os governos continuem trabalhando unidos nas questões relativas à Covid-19, uma vez que não se sabe por quanto tempo o Sars-CoV-2 continuará a circular no mundo.
Indicação
O medicamento é indicado para o tratamento da Covid-19 em adultos que não requerem oxigênio suplementar e que apresentam risco aumentado de progressão da doença para casos graves e cujas opções alternativas de tratamento de Covid-19 aprovadas ou autorizadas pela Anvisa não são acessíveis ou clinicamente adequadas.
Restrições de uso
O medicamento é de uso adulto, com venda sob prescrição médica, e não é recomendado durante a gravidez, a amamentação e em mulheres que podem engravidar e que não estão usando contraceptivos eficazes. Isso porque estudos de laboratório em animais mostraram que altas doses de molnupiravir podem afetar o crescimento e o desenvolvimento do feto.
Contraindicações
O medicamento é contraindicado nos seguintes casos:
- Para uso em pacientes com menos de 18 anos de idade.
- Para uso em mulheres grávidas.
- Para início do tratamento em pacientes que necessitam de hospitalização devido à Covid-19, uma vez que seus benefícios não foram observados em indivíduos quando o tratamento é iniciado após a hospitalização.
- Para uso por mais de cinco dias consecutivos.
- Para profilaxia pré-exposição ou pós-exposição para prevenção de Covid-19.
Tempo de uso
O medicamento deve ser utilizado durante os cinco primeiros dias após o aparecimento dos sintomas, de modo a evitar o desenvolvimento de uma versão resistente do vírus. Além disso, deve ser limitado a cinco dias consecutivos.
Posologia
A dosagem em pacientes adultos é de 800 mg (quatro cápsulas de 200 mg) por via oral, a cada 12 horas, e por cinco dias, com ou sem alimentos. O medicamento deve ser utilizado assim que possível após o diagnóstico de Covid-19 e dentro de cinco dias do início dos sintomas.
Orientação de dispensação
O molnupiravir é um medicamento que deve ser usado após a avaliação e a prescrição médica. Requer adequada dispensação farmacêutica, com orientações de que o medicamento é de uso individual e não pode ser repassado a terceiros sem avaliação e prescrição médica. Cumpre ao farmacêutico realizar também orientações tais como a importância da adesão ao tratamento, modo de administração e restrições.
Medicamento não substitui vacinas
Durante a reunião, o diretor-presidente da Agência, Antônio Barra Torres, enfatizou que a autorização é mais uma estratégia de tratamento na relação dos procedimentos médicos usados para reduzir os danos da pandemia.
“Esse é um medicamento de aplicação bastante específica, que demandará monitorização constante e que, portanto, não se trata de nenhuma panaceia de uso amplo e irrestrito no caso da pandemia de Covid-19, onde a vacina se impõe como carro-chefe”, afirmou Barra Torres.
Confira as apresentações das áreas técnicas
- Apresentação da Gerência-Geral de Medicamentos (GGMED)
- Apresentação da Gerência-Geral de Inspeção e Fiscalização Sanitária (GGFIS)
- Apresentação da Gerência de Farmacovigilância (GFARM)
Anvisa publica RDC sobre nitrosaminas e nova versão de guia
Confira a segunda versão do Guia 50/2021 e a Resolução da Diretoria Colegiada 677/2022 sobre controle de nitrosaminas.
AAnvisa informa que disponibilizou a Versão 2 do Guia 50/2021 e publicou a Resolução da Diretoria Colegiada (RDC) 677/2022 sobre controle de nitrosaminas em insumos farmacêuticos ativos (IFAs) e medicamentos. A nova versão do guia já está em vigência e a norma entrará em vigor no próximo dia 1º de junho.
O Guia esteve aberto por 90 dias e recebeu 26 contribuições. A planilha de contribuições está disponível para consultas. O documento reúne recomendações sobre a responsabilidade das empresas e apresenta estratégias de cálculos de limites, entre outros requisitos.
A RDC 677/2022 prevê o cumprimento dos requisitos de forma escalonada, em etapas, conforme o risco atribuído a cada produto. Tanto a regulamentação quanto o guia são aplicáveis a novos registros de medicamentos, assim como alterações pós-registro que possam resultar em formação de nitrosaminas, como mudanças relacionadas ao IFA, à composição e à embalagem do medicamento, não se restringindo exclusivamente a essas.
Entenda
As N-nitrosaminas ou nitrosaminas são compostos comumente encontrados na água, em alimentos defumados e grelhados, laticínios e vegetais. A exposição a esses compostos dentro de limites seguros representa baixo risco de danos à saúde. No entanto, acima de níveis aceitáveis e por longo período, a exposição às nitrosaminas pode aumentar o risco da ocorrência de câncer.
No caso dos medicamentos, a Agência Regulatória da Alemanha (Federal Institute for Drugs and Medical Devices – BfArM) e a Agência de Medicamentos Europeia (European Medicines Agency – EMA) suspenderam, em julho de 2018, as vendas de genéricos do medicamento valsartana. Isso ocorreu devido à verificação de mudanças no processo de produção do insumo farmacêutico ativo da valsartana, que levaram à formação da impureza N-nitrosodimetilamina (NDMA) em lotes que haviam sido produzidos por uma empresa chinesa. Nas semanas seguintes, foi constatado que o insumo farmacêutico ativo de outros fabricantes também apresentava a mesma impureza.
A N-nitrosodimetilamina (NDMA) é altamente tóxica, especialmente para o fígado, e reconhecida como carcinogênica a partir de estudos realizados em animais, sendo classificada pela Agência Internacional de Pesquisa em Câncer como provável agente carcinogênico para humanos.
Desde então, observou-se o aparecimento de relatos de que outros insumos farmacêuticos ativos de outras classes terapêuticas também são precursores conhecidos ou suspeitos de conterem NDMA e outras nitrosaminas potencialmente carcinogênicas.
No Brasil, a Anvisa recolheu mais de 200 lotes de medicamentos da classe das sartanas. Além disso, a Agência suspendeu a fabricação, a importação, a distribuição, a comercialização e o uso dos insumos farmacêuticos ativos com suspeita de contaminação.
Anvisa determina apreensão e proibição de unidades falsificadas do medicamento Humira AC
Agência orienta os serviços de saúde sobre como identificar se o medicamento é original ou falso.
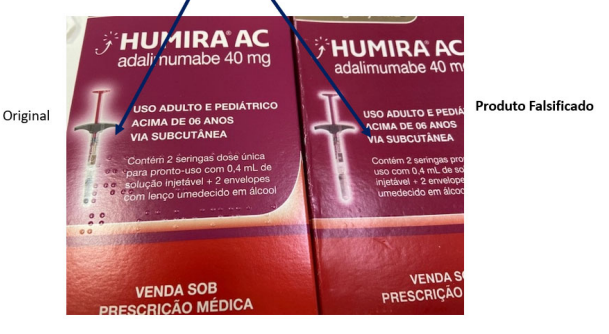
A Anvisa publicou no Diário Oficial da União (D.O.U.) desta quarta-feira (4/5) a determinação de apreensão e a proibição da distribuição, da comercialização e do uso de unidades falsificadas do lote 1146607 (fab 05/2021, val 01/2023) do medicamento Humira AC 40 mg, na forma de seringa preenchida. A medida foi divulgada por meio da Resolução-RE 1.413/2022.
Destaca-se que já havia sido publicada a RESOLUÇÃO-RE 3.744/2021, com o mesmo teor, mas referente ao lote 1135258 (fab. 05/2020, val. 04/2022).
A empresa detentora do registro – AbbVie Farmacêutica Ltda. – comunicou à Agência a falsificação de seringa preenchida de Humira AC, que apresenta as seguintes diferenças em relação ao medicamento original:
- diferença no fechamento do blíster;
- diferença na cor da marcação de segurança;
- diferenças na cor e no tamanho da fonte no blíster;
- dimensões diferentes das embalagens; e
- ausência da marcação em Braille na embalagem secundária.
Nesse sentido, a Anvisa solicita aos serviços de saúde que, caso recebam unidades do referido medicamento, antes de utilizá-las façam uma verificação minuciosa da embalagem e do rótulo do produto. Caso sejam identificadas unidades com as características de falsificação descritas acima, não utilizem os produtos e comuniquem o fato imediatamente à Agência, preferencialmente por meio do sistema Notivisa.
O caso segue em investigação pela Anvisa.
Confira abaixo as diferenças entre o produto original e o falsificado.



Webinar da Anvisa aborda pesquisa clínica em Cannabis medicinal
Agência promove seminário virtual no dia 16 de maio, às 15h, para orientar empresas e profissionais do setor sobre o tema.
AAnvisa irá realizar no dia 16 de maio, a partir das 15h, um seminário virtual sobre pesquisa clínica em Cannabis medicinal. A ideia é orientar as empresas e os profissionais do setor sobre a concepção e a realização de estudos clínicos, com finalidade de registro, para comprovação da eficácia e da segurança de produtos derivados de Cannabis sativa para uso medicinal.
Na ocasião, os participantes poderão esclarecer suas dúvidas sobre o tema. Para participar do evento, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 16/5, às 15h – Webinar: Pesquisa Clínica em Cannabis Medicinal
Webinar
O Webinar é um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizado ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento. Confira a página específica de webinares realizados pela Agência.
Fonte: Anvisa, em 04.05.2022.


