Restabelecida funcionalidade do sistema de peticionamento para cadastro de IFAs
Com a correção do erro, foram processadas e gravadas nos bancos de dados as informações sobre insumos farmacêuticos ativos apresentadas pelas empresas.
Anvisa informa que foi restabelecida a funcionalidade do sistema de Peticionamento Eletrônico que permite o cadastro de insumos farmacêuticos ativos (IFA), que a partir de agora está com a operação normalizada.
Com a correção do erro, foram processadas e gravadas nos bancos de dados as informações apresentadas pelas empresas (insumos cadastrados) desde meados de abril de 2021, quando o problema foi detectado.
Assim, solicitamos que as empresas avaliem seus cadastros e revisem as informações, realizando notificações e alterando o cadastro caso identifiquem inconsistências, visto que podem existir informações duplicadas ou obsoletas, devido ao tempo decorrido.
Recomendamos que tal avaliação seja realizada pelas empresas com a maior brevidade possível, em observância às disposições da Resolução de Diretoria Colegiada – RDC nº 30/2008, com vistas a evitar possíveis impactos nos processos de importação de IFA ou de inspeções.
Caso seja identificado novo erro, pedimos que acessem o formulário eletrônico Fale Conosco, informando: o nome e link do sistema com defeito; navegador e dispositivo usado para acessar o sistema; data e a hora aproximada do erro em questão e perfil específico (gestor de segurança, responsável legal ou usuário regulatório) usado quando ocorreu o erro; além de incluírem, preferencialmente como anexo, o passo a passo para chegar ao erro, isto é, os prints de cada etapa com os dados preenchidos.
Anvisa determina a apreensão de autotestes para Covid-19 falsificados
Consumidores devem adquirir autotestes somente em farmácias e drogarias. Venda em plataformas de comércio eletrônico e por meio de grupo de mensagem são proibidas.
Anvisa está determinando a apreensão e proibição da fabricação, importação, comércio, distribuição, propaganda e uso de autoteste de Covid-19 falsificados. Trata-se de falsificação do produto Novel Coronavírus (Covid-19) Autoteste Antígeno, registrado em nome da empresa CPMH - Comercio e Indústria de Produtos Medico - Hospitalares e Odontológicos Ltda, CNPJ nº 13.532.259/0001-25.
O produto falsificado possui características diferentes do produto original, que podem ser identificadas pelo consumidor ao observar a embalagem do produto.
- O produto falsificado possui as seguintes características:
- Presença de guia ilustrado explicando como realizar a execução do teste no verso da embalagem. O produto original não possui guia ilustrado.
- Número de registro diferente do aprovado, o número do registro do produto original registrado na Anvisa é 80859840213.
- Tampa de rosca sem orifício para gotejamento, o original possui uma tampa com orifício para gotejamento.
- Swab cotonete maior do que 9cm, o swab cotonete do produto original possui 9cm.
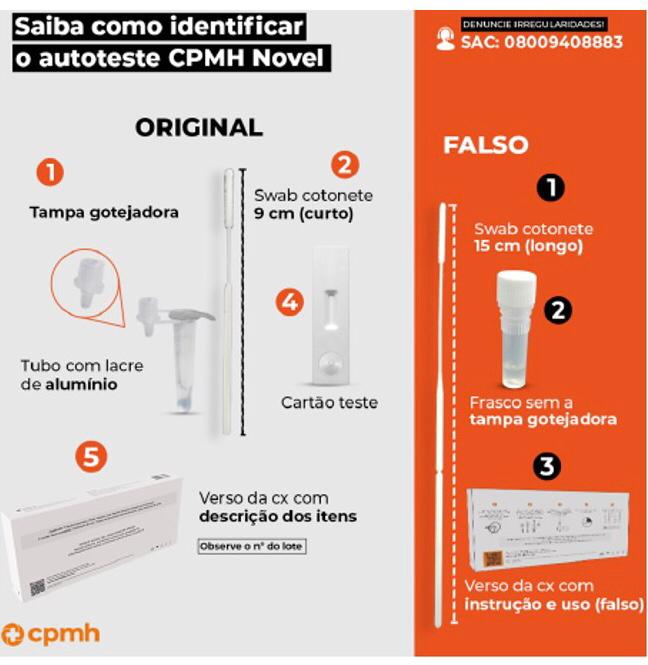
Assim, para evitar a aquisição de produtos falsificados, irregulares e de origem duvidosa, o consumidor deve adquirir os produtos apenas em farmácias e estabelecimentos licenciados pelo órgão de vigilância sanitária local para comércio de artigos médicos e ortopédicos.
O produto falsificado não traz nenhuma garantia de funcionamento ou de segurança para o consumidor.
Além disso, é importante ter cuidado com o comércio virtual. Apenas sítios de comércio eletrônico que pertencem a farmácias e estabelecimentos de saúde autorizados e licenciados pelos órgãos de vigilância sanitária podem vender esses produtos. A venda de autotestes para Covid-19 por meio de redes sociais e plataformas virtuais de e-commerce é considerada irregular.
Consulte aqui se a farmácia ou drogaria encontra-se autorizada pela Anvisa:
http://www7.anvisa.gov.br/datavisa/autorizacao_farmacia/Consulta_Empresa_Drogaria.asp
É fundamental que o consumidor adquira apenas autotestes registrados na Anvisa.
O autoteste tem registro? Consulte se está na lista de produtos para autoteste de COVID aprovados pela Agência:
https://app.powerbi.com/view?r=eyJrIjoiNGRmOTQ3NmQtNWQ1ZC00OTQ2LWEyOTgtMDY3ZjMyODkzNzZkIiwidCI6ImI2N2FmMjNmLWMzZjMtNGQzNS04MGM3LWI3MDg1ZjVlZGQ4MSJ9.
Caso prefira, você também pode consultar o produto por meio das informações do rótulo, como nome ou número de registro da Anvisa, e verificar neste link: https://consultas.anvisa.gov.br/#/saude/
A venda fora das condições estabelecidas pela Anvisa, além de ser irregular, pode facilitar o comércio de produtos falsificados e contribuir com a ocorrência de crimes contra a saúde pública. Produtos sem registro na Anvisa, ou comercializados de forma irregular produzem resultados não confiáveis.
Caso você identifique alguma possível irregularidade no comércio de produtos que está comercializando os autotestes, você pode entrar em contato com o órgão de vigilância sanitária mais próximo.
Em caso de suspeitas de produtos falsificados, propaganda irregular, ou oferta de produtos sem registro na Anvisa, bem como de comércio virtual de produtos irregulares, denuncie.
Para denunciar, acesse os links das Vigilâncias Sanitárias (http://portal.anvisa.gov.br/vigilancias-sanitarias) e da Ouvidoria da Anvisa (http://portal.anvisa.gov.br/ouvidoria). Forneça todas as informações disponíveis, incluindo o nome do produto e do fabricante e o local de aquisição, nota fiscal bem como, se possível, uma amostra do produto, para que as irregularidades sejam apuradas.
• Saiba mais sobre os autotestes: https://www.gov.br/anvisa/pt-br/assuntos/paf/coronavirus/autotestes
• Para saber se um produto – seja medicamento, alimento, cosmético, saneante ou produto para a saúde – está irregular, acesse o serviço de consulta a produtos irregulares: http://portal.anvisa.gov.br/produtos-irregulares .
Anvisa alerta sobre recolhimento de fórmulas infantis marca Similac, Alimentum e EleCare
Fórmulas infantis são alimentos voltados para alimentação de lactentes. O rótulo do produto deve informar o número de registro do produto na Anvisa.
Anvisa informa o recolhimento internacional das fórmulas infantis das marcas Similac, Alimentum e EleCare. Os produtos sob recolhimento (figura 1) têm um número de vários dígitos na parte inferior da embalagem, começando com os dois primeiros dígitos entre 22 e 37, contendo K8, SH ou Z2 e com data de validade de 1º de abril de 2022 ou posterior.
O recolhimento ocorre após o FDA iniciar uma investigação quatro internações de lactentes (bebês com menos de seis meses de idade) com um óbito, após o consumo de tais produtos.
Alerta internacional
A Agência recebeu um alerta internacional sobre o início do recolhimento voluntário de Fórmulas Infantis em Pó das marcas Similac, Alimentum e EleCare, da empresa Abbott Nutrition, fabricados na planta de produção de Sturgis, Michigan nos Estados Unidos. Segundo informações mais recentes, houve distribuição do produto Similac para o Brasil.
A Administração de Alimentos e Medicamentos dos Estados Unidos – FDA1 está investigando a ocorrência de quatro internações de lactentes (bebês com menos de seis meses de idade), com um óbito, após o consumo de tais produtos. Três dos bebês apresentavam infecção por Cronobacter sakazakii e um por Salmonella Newport.
As descobertas da FDA, até o momento, incluem vários resultados positivos de Cronobacter em amostras ambientais colhidas nas instalações da Abbott Nutrition da cidade de Sturgis, Estados Unidos, e uma revisão dos registros internos da Abbott também indica contaminação ambiental com Cronobacter sakazakii e a destruição do produto por causa da presença de Cronobacter sakazakii, de acordo com o alerta do FDA. A empresa afirma que, em análises laboratoriais, não detectou essas bactérias no produto e que o recolhimento seria preventivo.
O alerta foi realizado via Rede Internacional de Autoridades de Segurança Alimentar (Rede Infosan) e está disponível no site https://www.foodsafetynews.com/2022/02/multiple-countries-received-recalled-infant-formula-linked-to-deadly-outbreak/.
Como reconhecer os produtos recolhidos
Confira na ilustração abaixo como consultar a numeração dos lotes:

Figura 1. Exemplos de lotes sob recolhimento, dispostos no link https://www.foodsafetynews.com/2022/02/multiple-countries-received-recalled-infant-formula-linked-to-deadly-outbreak/.
A empresa norte-americana informou inicialmente que o recolhimento dos produtos ocorreria nos seguintes países de distribuição, além dos Estados Unidos: Austrália, Bahrein, Barbados, Bermudas, Canadá, Chile, China, Colômbia, Costa Rica, República Dominicana, Equador, Egito, Guam, Guatemala, Hong Kong, Índia, Indonésia, Israel, Jordânia, Kuwait, Líbano, Malásia, México, Nova Zelândia, Omã, Peru, Porto Rico, Qatar, Arábia Saudita, Cingapura, África do Sul, Sudão, Taiwan, Tailândia, Emirados Árabes Unidos, Reino Unido e Vietnã.
Em recente atualização, conforme informação disposta no link https://www.similacrecall.com/int/en/home.html, o Brasil passou a configurar na lista de países com possível distribuição do(s) produto(s) em questão, sob responsabilidade da Abbott Laboratórios do Brasil Ltda., que pode ser contactada pelo telefone 08008912690 ou pelo e-mail nutricaobrasil@abbott.com.
Assim, a Anvisa publicou medida preventiva, por meio da Resolução-RE Nº 682, de 3 de março de 2022, proibindo a importação, comercialização, distribuição, propaganda e uso das fórmulas infantis em pó das marcas Similac, Alimentum e EleCare da Abbott Nutrition que contenham grafado em suas rotulagens ou embalagens os seguintes códigos: os dois primeiros dígitos do código entre 22 a 37; contendo K8, SH ou Z2; e com data de validade de 01-04-2022 (abril de 2022) ou posterior.
Concomitantemente, a Anvisa abriu processo investigativo junto à importadora Abbott Laboratórios do Brasil Ltda. de forma a identificar os lotes específicos dos produtos que foram comercializados pela empresa em território nacional, e adotará as medidas pertinentes à ampla divulgação dos alertas necessários à retirada dos produtos no mercado brasileiro, tão logo receba as informações da empresa
Regularidade no Brasil das fórmulas infantis recolhidas
Fórmulas infantis são classificadas como alimentos que necessitam de registro na Anvisa previamente à comercialização ou importação. O rótulo do produto deve informar o número de registro do produto na Anvisa.
O consumidor deve ficar atento e adquirir somente produtos com procedência conhecida. Para confirmar o registro do produto, sugerimos consultar a base de dados disponível no portal da Anvisa: https://consultas.anvisa.gov.br/#/alimentos/.
Recomenda-se também que os consumidores evitem comprar fórmula infantil importada no comércio eletrônico, devido a dificuldade em conhecer a origem e regularidade do produto.
Atualmente, a única fórmula infantil registrada na Anvisa para Abbott Laboratórios do Brasil Ltda. é a FORMULA INFANTIL PARA LACTENTES E DE SEGUIMENTO PARA LACTENTES, marca: Similac Sensitive, registro 4.7432.0345.
O que fazer se encontrar um produto objeto do recolhimento?
Se você utiliza produtos da marca Similac, Alimentum ou EleCare, orientamos verificar o lote impresso no rótulo do produto (veja exemplo na figura). Se encontrar um dos lotes recolhidos, orientamos não consumir o produto ou oferecer para o consumo por bebês e entrar em contato com a Abbott Laboratórios do Brasil Ltda., pelo telefone 08008912690 ou e-mail nutricaobrasil@abbott.com, para receber orientações de como fazer a devolução do produto.
Orientações importantes para o uso de fórmulas infantis de maneira segura
Somente utilize fórmulas infantis com orientação de um profissional de saúde habilitado, como médico pediatra ou nutricionista. O Ministério da Saúde e a Organização Mundial da Saúde recomendam o aleitamento materno até os dois anos de idade ou mais e de maneira exclusiva até os seis meses de vida.
Leia todas as instruções de preparação presentes no rótulo. A correta higienização de utensílios que entram em contato com a fórmula, como mamadeiras, copos e colheres é fundamental para garantir a segurança do produto.
Além disso, deve-se sempre realizar a diluição na quantidade adequada e na temperatura segura (70ºC), que garante o menor risco de contaminação por microrganismos perigosos, como bactérias do gênero Cronobacter e Salmonella.
Anvisa publica norma e manual sobre uso compassivo de dispositivos médicos
A resolução publicada pela Agência regulamenta os programas de uso compassivo de dispositivos médicos. Já o manual esclarece dúvidas sobre o processo de submissão de solicitações.
A Anvisa destaca que foi publicada no Diário Oficial da União (D.O.U.) da última quarta-feira (2/3) a Resolução da Diretoria Colegiada (RDC) 608/2022, que trata do uso compassivo de dispositivos médicos.
Esta norma regulamenta os programas para esses dispositivos. Tais programas visam a assistência de pacientes que apresentem doença debilitante grave e ausência de alternativa terapêutica satisfatória no país para sua condição clínica, para os quais empresas interessadas queiram oferecer um dispositivo médico ainda em fase de validação, que possua uma relação benefício-risco favorável ao paciente.
Destaca-se também que este mecanismo de acesso a dispositivos médicos ainda em desenvolvimento já existe em vários países e permite que os pacientes que potencialmente possam se beneficiar de tecnologias promissoras consigam ter acesso a esses dispositivos a partir da iniciativa de desenvolvedores e do controle sanitário adequado para que o paciente possa ser monitorado de forma segura no decorrer da utilização do dispositivo.
É importante ressaltar que não se trata de uma pesquisa clínica, pois os dados obtidos de pacientes que utilizam dispositivos médicos em “uso compassivo” não subsidiam o registro de produtos inovadores, mas podem ser incorporados tanto no projeto dos dispositivos médicos quanto na sua avaliação clínica.
Com o objetivo de esclarecer eventuais dúvidas sobre o processo de submissão de solicitações de “uso compassivo de dispositivo médico”, a Agência elaborou um Manual de Orientação para Programas de Uso Compassivo de Dispositivos Médicos.
Webinar da Anvisa aborda o número do CAS em saneantes
Na próxima quinta-feira (17/3), às 10h, a Agência irá promover um seminário virtual sobre a importância do número do CAS nos produtos saneantes. Participe!
A Anvisa informa que irá realizar na quinta-feira (17/3), a partir das 10h, um seminário virtual para explicar o que é o número do CAS (Chemical Abstracts Service - Serviço de Resumos de Produtos Químicos), bem como sua importância regulatória para as formulações dos produtos saneantes.
O encontro contará com a presença de representantes da Agência e a participação do Dr. Gabriel Kaetan Baio Ferreira, integrante da equipe do CAS, uma divisão da American Chemical Society (Sociedade Americana de Química) no Brasil.
Na ocasião, os participantes poderão esclarecer suas dúvidas sobre essa identificação de substâncias químicas. Para participar do evento, basta clicar no link abaixo, no dia e horário agendados. Não é preciso fazer cadastro prévio.
Dia 17/3, às 10h - Webinar: O que é o número CAS e sua importância regulatória para as formulações dos produtos saneantes
Webinar
O webinar é um seminário virtual que tem como objetivo fortalecer as iniciativas de transparência da Anvisa, levando conteúdo e conhecimento atualizado ao público. A transmissão é via web e a interação com os usuários é feita em tempo real, por um chat realizado durante o evento. Confira a página específica de webinares realizados pela Agência.
Doenças raras: saiba mais sobre o registro de medicamentos
Regulamentação sobre o tema ocorreu em 2017, representando um avanço para o país e a melhoria da oferta de produtos à população. Ao todo, já são mais de 90 produtos registrados no país.
Nesta semana, a Anvisa preparou a divulgação de materiais para marcar a mobilização em torno do Dia Mundial das Doenças Raras, comemorado no último dia de fevereiro. O objetivo é divulgar informações sobre o tema, além de buscar apoio aos pacientes e incentivar pesquisas para melhorar o tratamento dessas doenças. Neste texto, você vai ficar sabendo um pouco mais sobre a regulamentação que tornou mais ágil o registro de medicamentos para doenças raras no Brasil. Confira!
Aprimoramento
Em 2017, a Agência aprimorou o processo para o registro de medicamentos com foco em doenças raras. Naquele ano, foi publicada a Resolução da Diretoria Colegiada (RDC) 205/2017, elaborada com o objetivo de estabelecer procedimentos especiais para o registro de novos medicamentos para tratamento, diagnóstico ou prevenção de doenças raras.
É importante destacar que, antes da publicação dessa resolução, a Anvisa já adotava critérios para priorização de análise de medicamentos destinados às doenças raras, mas esses critérios não eram específicos para esse grupo de doenças (RDC 37/2014). Ou seja, o processo contava com regras de priorização utilizando outros procedimentos, mas sem a análise diferenciada contida na regulamentação de 2017.
Em resumo, a importância atribuída à RDC 205/2017 diz respeito não apenas aos novos procedimentos, que tornaram a análise mais rápida. Essa resolução também previu critérios diferenciados em relação aos procedimentos de registro convencionais, sem comprometer a segurança, a eficácia e a qualidade da análise.
Alguns exemplos desses procedimentos são a possibilidade de submissão do dossiê de registro em formato CTD (do Inglês Common Technical Document - Documento Técnico Comum), a supressão de ensaios de controle de qualidade no Brasil, a aceitação de estudos de estabilidade em andamento e de estudos clínicos de fase III em andamento, além da utilização de comparadores internacionais em estudos de bioequivalência. A resolução também estabeleceu procedimentos especiais para a anuência prévia em pesquisa clínica e a certificação de Boas Práticas de Fabricação (BPF), entre outros.
Ao todo, já são mais de 90 produtos registrados no país. Portanto, a regulamentação para o registro desses medicamentos representou um avanço para o país, significando melhoria da oferta de produtos à população que necessita desses fármacos.
Confira abaixo o procedimento para a concessão de registro de medicamentos para doenças raras:
1º Passo - Reunião de pré-submissão
O primeiro passo para pedir o registro de um novo medicamento para doença rara é solicitar uma reunião de pré-submissão à Anvisa para apresentar o produto. A reunião deve ocorrer até 60 dias após o pedido da empresa.
Observação: No caso de medicamentos produzidos fora do Brasil, a solicitação de reunião de pré-submissão deve ser realizada em até 60 dias após a primeira solicitação de registro em outra autoridade reguladora. Isso significa que a empresa poderá submeter o registro em vários países, ao mesmo tempo.
2º Passo - Pedido de registro
Após a reunião, o solicitante deverá formalizar o pedido de registro no prazo de 30 dias. A partir da formalização do pedido, a Anvisa tem 60 dias para dar um parecer conclusivo ou solicitar mais informações. Se o parecer for conclusivo, o registro do medicamento é publicado, no máximo, em 30 dias.
Caso seja emitida exigência, a empresa terá 30 dias para apresentação do cumprimento de exigência, e a Agência avaliará o cumprimento em até 45 dias.
A solicitação de registro de um novo medicamento para doença rara é realizada conforme legislação específica para cada categoria regulatória, acrescida de documentação específica disposta na RDC 205/2017.
Alteração pós-registro
Neste contexto, cabe destacar também outra regulamentação da Anvisa: a RDC 204/2017. Relacionada ao enquadramento de petições na categoria prioritária, esta resolução prevê a priorização de análise de solicitações de alteração pós-registro (como nova indicação terapêutica ou ampliação de uso) de medicamentos destinados a doenças raras nas situações em que não houver alternativa terapêutica disponível ou quando apresentar uma melhoria significativa de segurança ou eficácia.
O que são doenças raras?
Considera-se doença rara aquela que afeta até 65 pessoas em cada 100 mil indivíduos, ou seja, 1,3 pessoas para cada duas mil. O número exato de doenças raras não é conhecido, mas estima-se que existam entre 6 mil e 8 mil tipos diferentes no mundo.
As doenças raras não têm cura e geralmente são crônicas, progressivas e incapacitantes, podendo ser degenerativas e também levar à morte. No entanto, um tratamento adequado é capaz de reduzir complicações e sintomas, assim como impedir o agravamento e a evolução da doença.
Alguns exemplos dessas enfermidades são: artrite reativa, doença falciforme, doença de Gaucher, epidermólise bolhosa, esclerose múltipla, fenilcetonúria, fibrose cística, hepatite autoimune, leucemia mieloide crônica, mieloma múltiplo, síndrome de Guillain-Barré e talassemias, entre outras.
Confira mais dados nos seguintes links:
- Doenças raras - informações gerais
- Acesse a lista de medicamentos registrados para doenças raras no Brasil
- Doenças Raras - Ministério da Saúde
- Dia Mundial e Dia Nacional das Doenças Raras - Biblioteca Virtual em Saúde
- Dia Mundial das Doenças Raras - Biblioteca Virtual em Saúde
* Com informações da Anvisa, do Ministério da Saúde (MS) e da Biblioteca Virtual em Saúde (BVS) do MS, que reúne dados de várias fontes.
Fonte: Anvisa, em 04.03.2022.


